1. GIỚI THIỆU
Nghề nuôi trồng thủy sản Việt Nam phát triển rất nhanh với mức độ thâm canh hóa ngày càng cao dẫn đến dịch bệnh thường xuyên xảy ra và ngày càng đa dạng. Bệnh trên cá tra được cho là một trong những thách thức quan trọng của ngành nuôi trồng thủy sản. Ngoài những bệnh thường gặp nhất như: xuất huyết, mủ gan, trắng gan, trắng mang, trắng da và vàng da…Gần đây, trương bóng hơi trên cá tra xuất hiện với tần số cao, gây thiệt hại cho người nuôi. Mặc dù, có một số công trình nghiên cứu về bệnh trên bóng hơi cá như: cá chép với bệnh viêm bóng hơi (Markiewicz, 1966 trích dẫn bởi Roberts, 2000), cá song với bệnh trương bóng hơi (Bùi Quang Tề, 2006), và sự nhiễm nấm Phialophora spp. lên bóng hơi cá hồi Đại Tây Dương (Lumsden, 2006). Tuy nhiên, “trương bóng hơi” trên cá tra là một vấn đề mới mẻ. Ở Việt Nam, hiện chưa có công trình nghiên cứu về bệnh này cũng như phương pháp phòng trị. Thực trạng cho thấy cần nhanh chóng xác định tác nhân gây bệnh trương bóng hơi trên cá tra, từ đó làm tiền đề cho các nghiên cứu tiếp theo để đưa ra biện pháp phòng trị và quản lý dịch bệnh hiệu quả.
2. VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1 Mẫu cá
Mẫu cá tra bệnh trương bóng hơi được thu trực tiếp từ 10 ao nuôi thâm canh ở Đồng Tháp, Cần Thơ, An Giang, Bến Tre. Tổng mẫu là 56 cá bệnh trương bóng hơi và 11 cá không biểu hiện bệnh (trọng lượng 200 – 900g), được thu suốt năm 2011. Mẫu được giữ lạnh và đưa về phòng thí nghiệm Bộ môn Sinh học và Bệnh thủy sản – Khoa Thủy Sản – Đại học Cần Thơ. Mẫu cá được phân tích trong ngày.
2.2 Phân lập và định danh nấm
2.2.1 Kiểm tra bệnh cá
Tiến hành kiểm tra kí sinh trùng trên các cơ quan mang, gan, thận, bóng hơi của 56 cá bệnh. Ngoài ra, quan sát tiêu bản tươi bên trong bóng hơi bệnh có nhuộm cotton-blue (x400 hoặc x1000) cũng được thực hiện. Tất cả cá bệnh sau kiểm tra đều phân lập vi khuẩn và nấm.
2.2.2 Phân lập nấm
Những mẫu xuất hiện sợi nấm hoặc bào tử được rửa 2 lần qua nước muối sinh lí (0,85% NaCl) tiệt trùng. Sau đó cấy một phần mẫu bệnh phẩm vào đĩa môi trường GYA có bổ sung Ampicilin và Streptomycin (liều lượng khoảng 500 µg/ml mỗi loại) để hạn chế tạp khuẩn (Hatai and Egusa, 1979). Đĩa cấy được ủ ở 280C từ 2-4 ngày để kiểm tra sự phát triển của nấm. Mẫu nấm tiếp tục cấy truyền 2-4 lần để có nấm thuần. Khi có nấm thuần cấy chuyển các chủng nấm và giữ lại cho định danh, cảm nhiễm.
2.2.3 Định danh nấm
Nấm được định danh theo khóa phân loại của de Hoog et al.,(2000) dựa vào đặc điểm khuẩn lạc trên môi trường GYA; đặc điểm hình thái bào tử, sợi nấm; kích thước bào tử và sợi nấm. Kích thước được đo và tính theo Nguyễn Thị Quỳ (2002).
Phương pháp nuôi cấy trên lam kính được thực hiện theo mô tả của de Hoog et al. (2000) để quan sát đặc điểm hình thái của bào tử và sợi nấm. Phương pháp này được thực hiện như sau: đặt lame lên que thủy tinh hình chữ V có lót giấy thấm bên dưới và giữ ẩm bằng nước cất. Sau đó cắt khối môi trường GYA (1x1x1 cm) đưa lên lame và cấy nấm vào 4 mặt bên của khối agar. Tất cả được đặt trong đĩa petri vô trùng. Đĩa cấy được ủ ở nhiệt độ 28oC từ 5-7 ngày cho nấm phát triển bao phủ lamen. Khi đó lấy lamen ra và đặt trên lame kính có sẵn giọt thuốc nhuộm cotton blue. Mẫu nhuộm được cố định bằng keo dán cho việc quan sát đặc điểm hình thái.
2.3 Thí nghiệm cảm nhiễm tái định danh
Địa điểm và cá cảm nhiễm: cá tra giống khỏe (15-25g) được thuần dưỡng 15 ngày và kiểm tra vi sinh 5 cá trước bố trí. Thí nghiệm được thực hiện tại Bộ môn Sinh học và Bệnh thủy sản –Trường Đại học Cần Thơ trong 31 ngày gây cảm nhiễm.
Chủng nấm: Hai chủng vi nấm xuất hiện với tần số cao từ các chủng nấm phân lập: F1P2 và F12P2 thuộc giống Fusarium sp. được chọn gây cảm nhiễm khẳng định tác nhân gây bệnh. Số lượng bào tử nấm được xác định bằng buồng đếm hồng cầu. Mật độ bào tử thí nghiệm lần lượt là 8x106 (mật độ cao) và 8x103 bào tử/ml (mật độ thấp) đối với F1P2; 6x106 ( mật độ cao) và 6x103 bào tử/ml (mật độ thấp) đối với F12P2.
Phương pháp cảm nhiễm: phương pháp tiêm được sử dụng gây nhiễm bằng cách tiêm 0,1ml dung dịch bào tử nấm vào phía trái vi bơi của cá. Ở lô đối chứng cá được tiêm 0,1 ml nước muối sinh lý (0,85% NaCl) tuyệt trùng. Thí nghiệm gồm 5 nghiệm thức, mỗi nghiệm thức có 10 cá thể với 3 lần lập lại. Suốt thời gian gây nhiễm không thay nước; cho cá ăn thức ăn viên 2 lần/ngày và kiểm tra định kỳ các chỉ tiêu môi trường 4 ngày/lần. Số cá chết ghi nhận lại và phân tích mẫu cá lờ đờ để xác định sự hiện diện của mầm bệnh vi nấm.
3. KẾT QUẢ VÀ THẢO LUẬN
3.1 Dấu hiệu bệnh lý
Gần đây, cá tra thâm canh thường gặp bệnh trương bóng hơi bùn phát sau 3 đến 5 tháng nuôi. Phần lớn cá trương bóng hơi giảm tăng trọng, cơ thể ốm yếu do bỏ ăn thời gian dài.
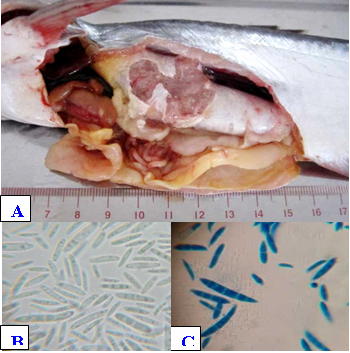
Giai đoạn nhiễm nhẹ, cá hoạt động bình thường khó phát hiện từ bên ngoài. Nhiễm nặng, cá bơi lờ đờ bờ ao đưa gai lưng khỏi mực nước đôi khi kèm theo bội nhiễm gây lở loét từ đầu đến vây lưng. Dấu hiệu đặc trưng là bóng hơi trương phồng, thành bóng hơi sưng dầy, bên trong chứa nhiều dịch và bóng khí (Hình 1A). Kiểm tra mẫu tươi phần bên trong bóng hơi (x1000) thấy nhiều bào tử (Hình 1B và 1C) và sợi nấm.
3.2 Kiểm tra bệnh cá
Tiến hành kiểm tra 56 cá bệnh tìm thấy 2 loại ký sinh trùng trên mang là trùng mặt trời (Trichodina) và sán 16 móc (Dactylogyrus) với cường độ nhiễm thấp trung bình 1 kí sinh trùng/thị trường. Không tìm thấy ký sinh trùng trong bóng hơi. Kết quả kiểm tra vi khuẩn phân lập được 1 chủng Pseudomonas sp. chiếm tỉ lệ 10%. Trong khi, quan sát mẫu tươi trên hầu hết cá có dấu hiệu trương bóng hơi thấy xuất hiện bào tử và sợi nấm.
3.3 Phân lập và định danh nấm
Từ 56 cá tra (200 -900g) trương bóng hơi đã phân lập được 44 chủng nấm chiếm 78,57%. Dựa vào đặc điểm hình thái; tốc độ phát triển của khuẩn lạc trên môi trường GYA; đặc điểm của sợi nấm và bào tử, các chủng nấm phân lập được xác định là giống Fusarium sp., với tần suất xuất hiện của giống nấm này là 100% trong tổng 44 chủng nấm phân lập.
Kết quả giải trình tự gen 28S rRNA và tra cứu trên BLAST SEARCH của 4 chủng vi nấm (2 chủng phân lập từ cá bệnh F1P2 và F12P2; 2 chủng thu từ cá cảm nhiễm F1P2 - tái phân lập và F12P2¬- tái phân lập) xác định được F1P2 và F1P2 - tái phân lập là loài Fusarium oxysporum; F12P2 và F12P2 - tái phân lập là loài Fusarium subglutinans.
Đặc điểm Fusarium sp.: trên môi trường GYA, khuẩn lạc phát triển nhanh ở 28°C, đường kính khuẩn lạc đạt 40 – 50 mm sau 7 ngày nuôi cấy.
.png)
Hình2: Đặc điểm hình thái Fusarium oxysporum. (F1P2): (A) Khuẩn lạc chủng F1P2 trên môi trường GYA ở 28oC sau 7 ngày nuôi cấy, (B) Khuẩn lạc mặt dưới, (C) Sợi nấm phân nhánh có vách ngăn (mũi tên đỏ) (cotton-blue, x1000), (D) Đại bào tử (cotton-blue, x1000, (E) Cuống bào tử (mũi tên xanh) (nhuộm cotton blue, x1000) và (F) Cuống bào tử (cotton-blue, x1000)
Khuẩn lạc có màu hồng nhạt, các sợi nấm trắng hồng kèm theo vòng tròn vàng nhạt mọc nhô khỏi bề mặt môi trường nuôi cấy (Hình 2A và 2B). Sợi nấm có vách ngăn và phân nhánh (Hình 2C) với đường kính 2,5-5 µm. Cuống bào tử chồi phát triển nhiều (Hình 2F). Bào tử có 2 dạng: đại bào tử và tiểu bào tử, đôi khi xuất hiện bào tử vách dày. Các đại bào tử có hình thuyền hơi cong và nhỏ về hai đầu, có từ 1-5 vách ngăn (Hình 2D và 2E).
Căn cứ vào khoá phân loại nấm của de Hoog et al. (2000) xác định các chủng nấm có đặc điểm trên thuộc giống Fusarium sp.. Tần số xuất hiện của giống Fusarium sp. là 100% trong tổng 44 chủng nấm phân lập được.
Giống nấm này được tìm thấy nhiều trên giáp xác. Một số nghiên cứu về bệnh đen mang ở tôm he P. japonicus (Egusa và Ueda, 1972; Khoa và Hatai, 2005), tôm sú và trên tôm hùm Homarus americanus (Lightner và Fontain, 1975) xác định là do nấm Fusarium sp. Gần đây, Fusarium sp. cũng được tìm thấy trên cá rô đồng bệnh nấm nhớt với tỷ lệ 30% (Trần Ngọc Tuấn, 2010), trên cá lóc 14,3% (Lư Chí Tài, 2010).
Nhìn chung, giống nấm này được tìm thấy bên ngoài cơ thể động vật thủy sản. Như vậy, đây là kết quả đầu tiên phân lập được Fusarium sp. trên bóng hơi (nội quan) cá tra nuôi thâm canh.
3.4 Thí nghiệm gây cảm nhiễm
3.4.1 Dấu hiệu bệnh lý
Kết quả quan sát dấu hiệu bệnh lý của cá cảm nhiễm 2 chủng F1P2 (Fusarium oxysporum) và F12P2 (Fusarium subglutinans ) so với dấu hiệu bệnh lý ngoài tự nhiên thì tương tự nhau. Sau 2 ngày cảm nhiễm, cả 2 chủng tiêm mật độ cao, cá có dấu hiệu xuất huyết ngoài, mất thăng bằng, bơi không định hướng, bơi xoắn ốc, ngửa bụng và yếu nhanh chống. Mỗi ngày khoảng 2-3con yếu/bể. Triệu chứng này kéo dài 5-6 ngày. Quan sát thấy được cá yếu thường từ 6h sáng và 9h tối.
Những bể tiêm chủng F1P2 (8x106 bào tử/ml) từ cuối tuần thứ I trở đi, cá vào giai đoạn ủ bệnh không phát hiện cá khờ. Tuy nhiên, cá khờ xuất hiện từ cuối tuần III cho đến lúc kết thúc thí nghiệm. Giai đoạn này giống ngoài tự nhiên hơn, cá thường bơi ở mặt bể và yếu dần. Trung bình 2 – 5 ngày phân tích một cá/bể. Cá biểu hiện lờ đờ khoảng 2-3 ngày mới yếu hẳn. Tuy nhiên, một số biểu hiện nhanh khoảng 24h là kiệt sức. Trong khi, F12P2 (6x106) sau tuần thứ I cho đến kết thúc thí nghiệm không phát hiện cá khờ.
Cá tiêm mật độ thấp của cả 2 chủng đều không thấy biểu hiện bên ngoài.
3.4.2 Mức độ gây bệnh
Kết quả tái phân lập từ bóng hơi cá tra được tiêm chủng F1P2 cho thấy có 80% nhiễm nấm ở mật độ cao; 20% nhiễm nấm ở mật độ thấp. Đa số gan, thận và cơ cũng nhiễm nấm. Và tỉ lệ biểu hiện trương bóng hơi ở mật độ cao và thấp lần lược là 46,15% và 3,33%. Trong khi, cá tra giống tiêm chủng F12P2 thì tỉ lệ nhiễm nấm là 80% ở mật độ cao và 3,33% ở mật độ thấp. Tuy nhiên, tỉ lệ biểu hiện bệnh thì thấp hơn chỉ có 13,33% ởmật độ cao và 0% ở mật độ thấp.
Kết quả cho thấy, tỉ lệ nhiễm nấm ở mật độ cao tương đương nhau ở cả 2 chủng tiêm. Và kết quả biểu hiện bệnh chênh lệch cao. Điều này có thể do mật độ tiêm của chủng F1P2 (F.oxysporum) cao hơn F12P2 (F.subglutinans). Vì thế, ở mật độ cao cả 2 chủng đều có mầm bệnh xâm nhập vào cơ thể. Tuy nhiên, cả 2 chủng có thời gian cảm nhiễm như nhau nhưng F12P2 mật độ thấp hơn vì thế không đủ thời gian biểu hiện bệnh. Điều này cũng giải thích được rằng cá tiêm chủng F12P2 mật độ thấp không phân lập được nấm. Do mật độ bào tử thấp nên cá tiêu diệt được mầm bệnh.
Ở bể đối chứng tỉ lệ nhiễm nấm là 0% và tỉ lệ sống đạt 100% sau 31 ngày cảm nhiễm.
4. KẾT LUẬN VÀ ĐỀ XUẤT
4.1 Kết luận
Dựa vào đặc điểm hình thái và kích thước bào tử, sợi nấm, đặc điểm cuốn bào tử và bào tử định danh được 44 chủng nấm phân lập trên cá tra biểu hiện trương bóng hơi thuộc giống Fusarium sp. chiếm tỷ lệ 100% trên tổng 56 cá bệnh.
Kết quả giải trình tự gen 28S rRNA và tra cứu trên BLAST SEARCH định danh được F1P2 và F1P2 - tái phân lập là loài Fusarium oxysporum; F12P2 và F12P2 - tái phân lập là loài Fusarium subglutinans. Kết quả cho thấy 2 loài F. oxysporum và F. subglutinans là tác nhân chính của bệnh này.
Kết quả cảm nhiễm cho thấy tỉ lệ biểu hiện bệnh tiêm chủng F1P2lần lượt là 46,15% (mật độ cao) và 3, 33 % (mật độ thấp) và tiêm F12P2 lần lượt là 13,33% (mật độ cao) và 0% (mật độ thấp).
4.2 Đề xuất
Trương bóng hơi trên cá tra hiện chưa được nghiên cứu nhiều. Vì vậy, tiếp tục nghiên cứu thuốc- hóa chất đặc trị giống nấm này là vấn đề bức thiết.
LỜI CẢM ƠN
Tác giả xin bày tỏ lòng biết ơn đến sự giúp đỡ và tạo điều kiện của tất cả cán bộ Bộ môn Sinh học và Bệnh Thủy Sản, Khoa thủy sản, Đại học Cần Thơ trong suốt thời gian thực hiện nghiên cứu tại Khoa Thủy Sản. Xin chân thành biết ơn!
TÀI LIỆU THAM KHẢO
Bùi Quang Tề, 2006. Bệnh truyền nhiễm của động vật thủy sản. Bệnh học thủy sản phần 2. Viện nghiên cứu nuôi trồng thủy sản 1: 88-219.
de Hoog, G.S., J. Guarro, J. Gené and M.J. Figueras. 2000. Atlas of clinical fungi. 2nd edition. Centraalbureau voor schimmelculture. 1126p.
Egusa, S. and T. Ueda, 1972. A Fusarium sp. associated with black gill disease of the kuruma prawn (Penaeus japonicus Bate). Bulletin of the Japanese society of scientific fisheries 38(11):1253-1260.
Hatai, K. and S. Egusa, 1979. Studies on the pathogenic fungus of mycotic granulomatosis-III. Development of the medium for MG-fungus. Fish Pathology. 13(3):147-152.
Khoa, L.V. and K. Hatai, 2005. First case of Fusarium oxysporum infection in cultured kuruma prawn (Penaeus japonicas) in Japan. Fish Pathology 40(4):195-196.
Lightner, D. V. and C. T. Fontaine. 1975. A mycosis of the American lobster Homarus americanus caused by Fusarium sp. Journal of Invertebrate 25: 239-245.
Lư Chí Tài, 2010. Tìm hiểu một số mầm bệnh thường gặp trên cá lóc (Channa striata) trong ao nuôi thâm canh. Luận văn Cao học. Khoa Thủy sản, Đại học Cần Thơ.
Lumsden, 2006. Gastrointestinal tract, Swimbladder, Pancreas and Peritoneum. In: Ferguson et al., (Editors). Systemic pathology of fish: A text and atlas of normal tissues in teleosts and their responses in disease: 188-193.
Nguyễn Thị Quỳ. 2002. Lý sinh học (phần thực tập). Nhà xuất bản Khoa học và Kỹ thuật. 107 trang.
Roberts.R.J and H.D. Rodger, 2000. Pathophysiology and systematic pathology teleosts. In: Roberts (editor). Fish pathology: 83-84.
Trần Ngọc Tuấn, 2010. Phân lập và định danh nấm trên cá rô đồng (Anabas testudineus) nuôi thâm canh. Luận văn Cao học. Khoa Thủy sản, Đại học Cần Thơ.

_1772730767.png)











_1772730767.png)



_1772608222.png)


