Các nguồn carbohydrate lên men, chẳng hạn như cám gạo lên men, là nguồn bổ sung thức ăn hiệu quả nhất vì chúng có vai trò hiệu quả như tiền chế phẩm sinh học và men vi sinh (Yang và cộng sự, 2021, Haryati và cộng sự, 2015). Quá trình lên men sau đó cải thiện khả năng hòa tan trong nước, độ ngon miệng, khả năng tiêu hóa chất dinh dưỡng và chức năng miễn dịch của thức ăn (Abdel-Tawwab và cộng sự, 2022).
Kỹ thuật aquamimicry, kết hợp cám gạo lên men, phục vụ hai chức năng thiết yếu. Đầu tiên, nó tạo ra biofloc để duy trì chất lượng nước tốt bằng cách tạo ra sự hình thành và ổn định cộng đồng vi sinh vật dị dưỡng. Những vi sinh vật này giúp cải thiện chất lượng nước của hệ thống bằng cách loại bỏ nitơ vô cơ khỏi nước thải bằng cách hấp thụ các hợp chất nitơ tạo ra protein vi sinh vật tại chỗ. Thứ hai, nó hỗ trợ động vật phù du trong ao và cung cấp dinh dưỡng bổ sung cho tôm. Ngoài việc ấu trùng tôm có thể trực tiếp sử dụng thức ăn sống, người ta tin rằng tôm vẫn có thể sử dụng trứng động vật phù du khi chúng chìm xuống đáy ao (Romano et al., 2018). Thực phẩm tự nhiên chứa một số thành phần quan trọng, bao gồm protein, lipid, carbohydrate, axit amin, vitamin, khoáng chất và axit béo. Do đó, nó thường được gọi là “viên nang dinh dưỡng sống” (New, 1998). Hơn nữa, nguồn carbon cung cấp tỷ lệ carbon:nitơ (C:N) cân bằng cho các vi khuẩn dị dưỡng để phát triển và hoạt động; do đó, các chất chuyển hóa nitơ độc hại như amoniac được chuyển đổi thành protein vi sinh vật (Avnimelech, 2009). Do đó, carbohydrate lên men và men vi sinh được sử dụng trong hệ thống nuôi trồng thủy sản có thể giảm thiểu đáng kể chi phí thức ăn trong nuôi tôm.
Một số nghiên cứu đã được thực hiện trên các hệ thống nuôi trồng thủy sản, tập trung vào nuôi tôm thẻ chân trắng (Litopenaeus vannamei) để so sánh Biofloc với công nghệ Aquamimicry và đánh giá hiệu quả của cám gạo lên men đến hoạt động năng động của vi sinh vật. Tuy nhiên, trên tôm sú hiện vẫn chưa ghi nhận nghiên cứu nào. Do đó, nghiên cứu mới đây được thực hiện nhằm đánh giá tác động của kỹ thuật sử dụng cám gạo lên men được làm giàu bằng men vi sinh làm chất kích thích thức ăn tự nhiên đối với sự tăng trưởng, khả năng miễn dịch và tỷ lệ sống của tôm sú (Penaeus monodon) được nuôi bằng công nghệ Aquamimicry.
Thiết kế ao thủy sinh
Một thí nghiệm thực địa đã được tiến hành tại một trang trại nuôi tôm nằm ở vùng ven biển Bangladesh. Phân tích được thực hiện tại Phòng thí nghiệm Sinh học Thủy sản và Môi trường Thủy sản, Đại học Nông nghiệp Bangabandhu Sheikh Mujibur Rahman (BSMRAU), Bangladesh. Các ao truyền thống hiện có và ao Aquamimicry có diện tích 1214 m2 được sử dụng. Thể tích mỗi ao khoảng 1850 m3. Các ao nuôi được thiết kế sử dụng lớp lót bằng HDPE trên bờ kè và một máy bơm hút ở hố trung tâm (Hình 1). Các lớp lót HDPE được dựng lên để chống xói mòn đất và hố trung tâm được đào để loại bỏ chất thải nuôi trồng tích tụ. Mỗi nghiệm thức bao gồm ba lần lặp lại và chín ao được sử dụng trong thí nghiệm. Bờ ao được rào lại để đảm bảo an toàn sinh học. Hai máy sục khí 1HP được đặt ở hai góc ao nuôi.

Hình 1. Thiết kế ao nuôi với hố trung tâm (a) và ao thí nghiệm (b).
Bảng 1. So sánh giữa ao nuôi truyền thống và ao aquamimicry
Lên men cám gạo
Trước khi lên men, cám gạo không trấu được xay và sàng nhỏ. Năm lít nước được trộn với một kg cám gạo xay và ủ trong 24 giờ trong điều kiện sục khí liên tục để lên men. Một loại men vi sinh thương mại có tên Red Cap (Baxel Company Limited, Thái Lan), chứa Bacillus subtilis, Bacillus amyloliquefaciens và Bacillus valismortis ở nồng độ 2 × 1010 (CFU/g), được sử dụng để lên men. Trước khi lên men, độ pH được đo bằng máy đo pH kỹ thuật số (Hach) và được điều chỉnh ở mức 6,0–7,0 bằng canxi cacbonat.
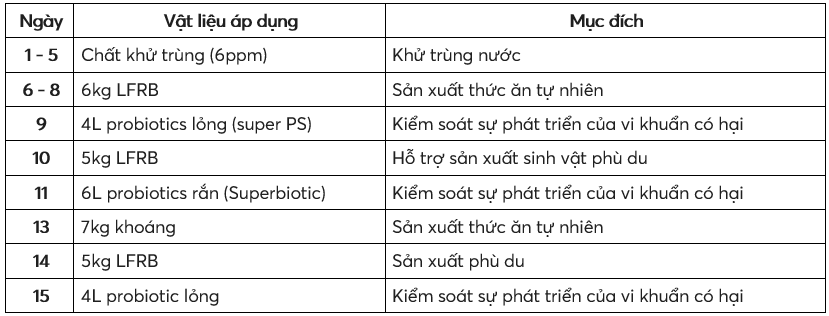
Bảng 2. Các bước sản xuất thức ăn tự nhiên khác nhau trong quá trình chuẩn bị ao nuôi
Chuẩn bị ao nuôi
Các bước thực hiện trong quá trình chuẩn bị ao nuôi để sản xuất thức ăn tự nhiên trong ao Aquamimicry được liệt kê trong Bảng 2; không có quy trình nào trong số này được tuân thủ đối với các ao đối chứng. Hai chế phẩm sinh học Super PS (Feedwale, Ấn Độ) và Superbiotic (CPF Private Limited, Ấn Độ), có chứa Rhodobacter spp. và Rodococcus spp., với nồng độ 3×108 cfu đã được sử dụng trong quy trình này. Như đã nêu trên nhãn bao bì, những vi khuẩn này hoạt động theo mối quan hệ hiệp lực để phân hủy sinh học các chất ô nhiễm hữu cơ, giảm hydro sunfua và khí độc. Sự phát triển thức ăn tự nhiên trong ao được xác nhận bằng cách quan sát màu sắc của nước và mật độ sinh vật phù du trong phòng thí nghiệm.
Thiết kế thí nghiệm nuôi tôm
Thí nghiệm được chia thành ba nghiệm thức, mỗi nghiệm thức có ba lần lặp lại, dựa trên chế độ chuẩn bị ao và sử dụng thức ăn (Bảng 3). Tôm sú được cho thích nghi vào ao ương, thả giống (0,50 ± 0,11 g) và nuôi (10 m−2) vào ao nuôi với ba chế độ cho ăn. Độ mặn của ao nuôi là 5,47± 0,53 ppt. Tôm được cho ăn 100% thức ăn thương mại (CF), 10% LFRB + 90% CF và 30% LFRB + 70% CF ở nhóm đối chứng (T0), Nghiệm thức (T1) và Nghiệm thức 2 (T2), tương ứng. Theo nhãn bao bì của thức ăn thương mại đó, thành phần dinh dưỡng (cơ sở chất khô) là: Độ ẩm (Tối đa):11%, Protein thô (Tối thiểu):29%, Chất béo (Tối thiểu): 7%, Carbohydrate (Tối đa): 22%, Chất xơ (Tối đa): 3,5%, Tro (Tối đa): 10%, Canxi (Tối đa): 2,5% và Phốt pho (Tối thiểu): 2%. Thức ăn được cho ăn theo tỷ lệ 10%, 5% và 4% trọng lượng cơ thể cho các trọng lượng tương ứng là 1–5, 5–10 và 10–30 g.
Bảng 3. Thiết kế thí nghiệm nuôi tôm
Kết quả về thông số chất lượng nước
Giá trị trung bình trung bình của các thông số hóa lý, chẳng hạn như nhiệt độ, oxy hòa tan (DO), pH, độ mặn, độ kiềm, amoniac và độ trong suốt trong giai đoạn thử nghiệm với các nghiệm thức khác nhau, được trình bày trong Bảng 4. Không có sự khác biệt đáng kể (P > 0,05) về nhiệt độ, DO hoặc độ kiềm trong số các nghiệm thức trong thời gian thử nghiệm. Trong số các nghiệm thức, các ao xử lý aquamimicry có mức độ trong suốt, pH và độ mặn thấp hơn đáng kể (P<0,05) so với các ao đối chứng, trong đó T2 thể hiện các giá trị thấp nhất. Không có độc tính amoniac được quan sát thấy trong các ao nuôi trong thời gian thử nghiệm.
Bảng 4. Các thông số chất lượng nước trung bình trong thí nghiệm
Số lượng sinh vật phù du trung bình ở các ao trong thời gian thử nghiệm được thể hiện trong Hình 2. Số lượng sinh vật phù du ở ao T1 và T2 cao hơn đáng kể so với ao nuôi đối chứng. Tổng cộng, lượng mưa là 217,04 mm được ghi nhận trong khoảng thời gian từ tuần thứ 2 đến tuần thứ 4 của thí nghiệm và dẫn đến số lượng sinh vật phù du giảm; tuy nhiên, tỷ lệ trong ao T1 và T2 vẫn cao hơn đáng kể so với ao đối chứng (T0). Lượng sinh vật phù du trung bình là cao nhất (9,75×103 tế bào/L) ở T2 và thấp nhất (4,5 ×103 tế bào/L) trong các ao đối chứng.
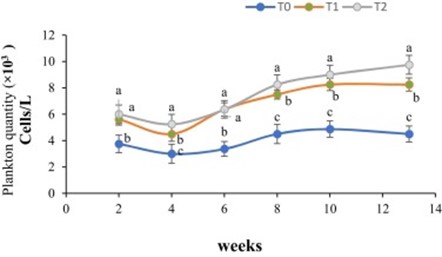
Hình 2. Số lượng sinh vật phù du trong các ao thí nghiệm
AGR (g/ngày) và SGR (%/ngày) của tôm sú trong thí nghiệm được liệt kê trong Bảng 5. Tăng trọng hàng tuần và tỷ lệ sống (%) của các nghiệm thức được thể hiện trong Hình 3, Hình 4. SGR cao nhất và thấp nhất được quan sát thấy ở nghiệm thức T2 và T0. Có sự khác biệt đáng kể (P<0,05) về SGR giữa hai nghiệm thức xử lý (T1 và T2) và đối chứng (T0). Ở tuần thứ 11, tăng trọng trung bình của tôm cao nhất ở T2 (19 ± 2,02 g) và thấp nhất ở T0 (10 ± 1,5 g). Cuối cùng, trọng lượng trung bình của tôm cao hơn đáng kể ở T2 (33 ± 1,12 g). Tăng trọng trung bình hàng ngày của tôm lần lượt là 0,05 ± 0,00, 0,34 ± 0,05 và 0,47 ± 0,06 (g/ngày) ở các nghiệm thức T0, T1 và T2. Tỷ lệ sống hàng tuần (Hình 2) chỉ ra rằng tôm có tỷ lệ sống ở T2 cao hơn ở T1 và T0. Sau tuần thả giống thứ 11, hầu hết tôm ở ao đối chứng đều chết (T0). Vào cuối thí nghiệm, tỷ lệ sống của tôm ở T2 (55%) và T1 (45%) cao hơn đáng kể so với T0 (1%).
Bảng 5. Tốc độ tăng trưởng trung bìnhvà tốc độ tăng trưởng đặc trưng của tôm sú trong thí nghiệm 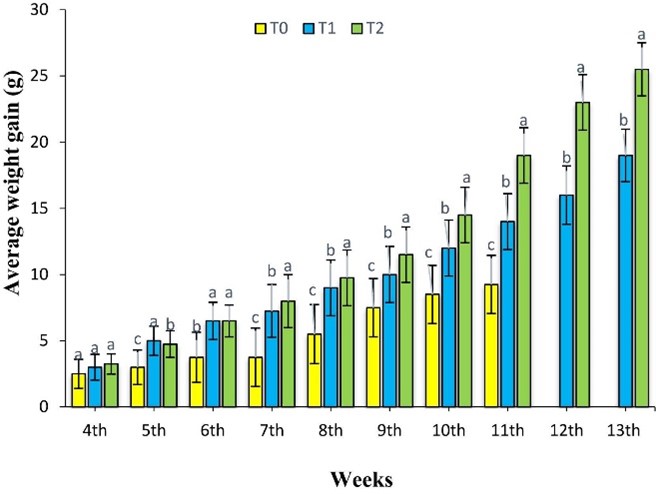
Hình 3. Tăng trọng trung bình hàng tuần của tôm sú trong thí nghiệm sau 90 ngày (Lấy mẫu được bắt đầu từ tuần thả giống thứ 4). 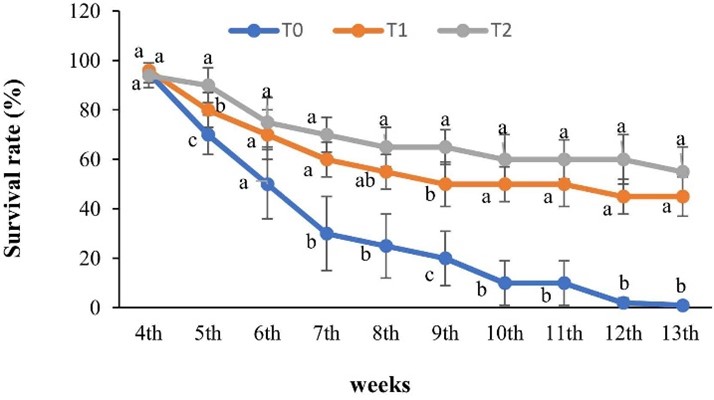
Hình . Tỷ lệ sống hàng tuần của tôm sú trong thí nghiệm sau 90 ngày (Lấy mẫu được bắt đầu từ tuần thả giống thứ 4)
Nghiên cứu này cho thấy kết quả thuận lợi đối với hiệu suất tăng trưởng, khả năng miễn dịch và tỷ lệ sống của tôm sú khi áp dụng công nghệ Aquamimicry. Các ao xử lý bằng Aquamimicry, đặc biệt là T2 với 70% CF + 30% LFRB, cho thấy hiệu suất tăng trưởng, tỷ lệ sống và các thông số miễn dịch tốt nhất đối với tôm so với nghiệm thức đối chứng. Do đó, công nghệ này có tiềm năng lớn để cải thiện tốc độ tăng trưởng, tỷ lệ sống và khả năng miễn dịch tổng thể trong sản xuất tôm sú.
Kết quả về hiệu suất tăng trưởng và tỷ lệ sống
AGR (g/ngày) và SGR (%/ngày) của tôm sú trong thí nghiệm được liệt kê trong Bảng 5. Tăng trọng hàng tuần và tỷ lệ sống (%) của các nghiệm thức được thể hiện trong Hình 3, Hình 4. SGR cao nhất và thấp nhất được quan sát thấy ở nghiệm thức T2 và T0. Có sự khác biệt đáng kể (P<0,05) về SGR giữa hai nghiệm thức xử lý (T1 và T2) và đối chứng (T0). Ở tuần thứ 11, tăng trọng trung bình của tôm cao nhất ở T2 (19 ± 2,02 g) và thấp nhất ở T0 (10 ± 1,5 g). Cuối cùng, trọng lượng trung bình của tôm cao hơn đáng kể ở T2 (33 ± 1,12 g). Tăng trọng trung bình hàng ngày của tôm lần lượt là 0,05 ± 0,00, 0,34 ± 0,05 và 0,47 ± 0,06 (g/ngày) ở các nghiệm thức T0, T1 và T2. Tỷ lệ sống hàng tuần (Hình 2) chỉ ra rằng tôm có tỷ lệ sống ở T2 cao hơn ở T1 và T0. Sau tuần thả giống thứ 11, hầu hết tôm ở ao đối chứng đều chết (T0). Vào cuối thí nghiệm, tỷ lệ sống của tôm ở T2 (55%) và T1 (45%) cao hơn đáng kể so với T0 (1%).
Nghiên cứu này cho thấy kết quả thuận lợi đối với hiệu suất tăng trưởng, khả năng miễn dịch và tỷ lệ sống của tôm sú khi áp dụng công nghệ Aquamimicry. Các ao xử lý bằng Aquamimicry, đặc biệt là T2 với 70% CF + 30% LFRB, cho thấy hiệu suất tăng trưởng, tỷ lệ sống và các thông số miễn dịch tốt nhất đối với tôm so với nghiệm thức đối chứng. Do đó, công nghệ này có tiềm năng lớn để cải thiện tốc độ tăng trưởng, tỷ lệ sống và khả năng miễn dịch tổng thể trong sản xuất tôm sú.










_1769663223.jpg)

_1769399561.jpg)
_1762138517.jpg)







