Sự phát triển và mở rộng quy mô sản xuất nhanh chóng của ngành nuôi tôm nước lợ đi kèm với các vấn đề về dịch bệnh, một trong những bệnh được quan tâm hàng đầu hiện nay là bệnh do vi bào tử trùng – Enterocytozoon hepatopenaei (EHP) – gây ra trên cả tôm thẻ chân trắng (L. vannamei) và tôm sú (P. monodon). Tôm nuôi bị nhiễm EHP có hội chứng chậm lớn và thường đi kèm với việc nhiễm bệnh do các tác nhân cơ hội như Vibrio, MBV (Monodon Baculovirus), HPV (Hepatopancreatic Parvovirus),...
Lịch sử và một số ảnh hưởng của EHP với ngành công nghiệp nuôi tôm thế giới
Vi bào tử trùng (EHP – Enterocytozoon hepatopenaei) được nghiên cứu và phát hiện gây bệnh trên 3 loài tôm he được nuôi [P. monodon, L. vannamei (Thitamadde và ctv, 2016) và P. stylirostris (Tang và ctv, 2016)]. Bệnh được báo cáo lần đầu trên tôm sú (P.monodon) ở Thái Lan vào năm 2004 (Chayaburakul và ctv, 2004). Những năm sau đó, được phân lập trên tôm sú và tôm thẻ chân trắng ở một số nước Đông Nam Á, Trung Quốc và Ấn Độ.
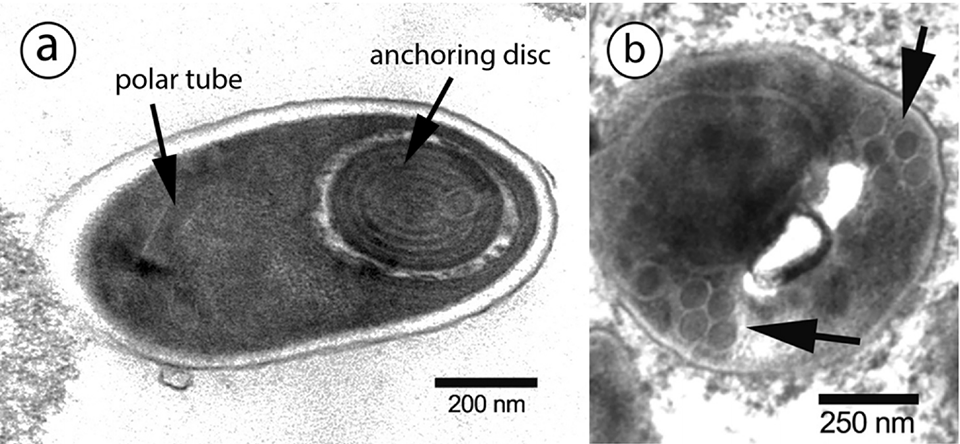
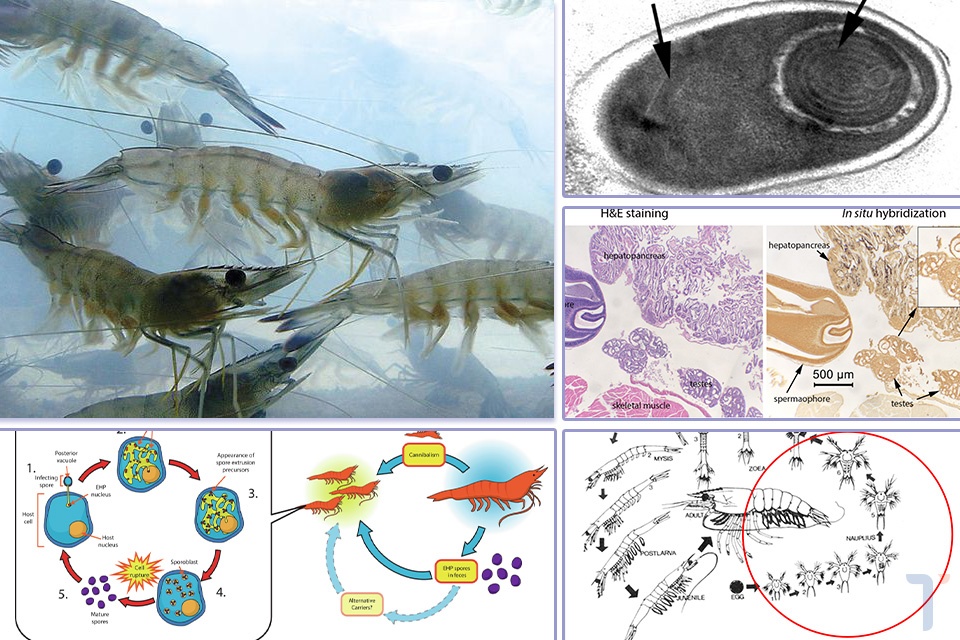
Hình 1. Ảnh dưới kính hiển vi điện tử của vi bào tử trùng EHP theo mặt cắt ngang và dọc cho thấy một polar tube là một bó có 5-6 sợi (mũi tên). Ảnh: Chaijarasphong và ctv, 2020.
Theo báo cáo của Chayaburakul (2004), ngành công nghiệp nuôi tôm sú (P. monodon) ở Thái Lan phải đối mặt với hội chứng tăng trưởng chậm trên tôm sú (Monodon Slow Growth Syndrome – MSGS) gây thiệt hại cho ngành công nghiệp này xấp xỉ 13 tỷ baht (khoảng 310 triệu USD$) vào năm 2002. Cụ thể là làm giảm khối lượng tăng trưởng trung bình hằng ngày (Average Daily Weight Gain – ADG) khoảng 0,2 đến 0,3 g/ngày xuống còn 0,07 đến 0,15 g/ngày.
Theo báo cáo của Tang và ctv (2017) ở Venezuela, Tôm thẻ chân trắng P. vannamei bị nhiễm EHP cũng không cho dấu hiệu rõ ràng, triệu chứng duy nhất là sự chênh lệch, không đồng đều về kích cỡ của tôm và giảm tăng trưởng chỉ 0,58 g/tuần (khoảng 0,1g/ngày). Tỉ lệ sống trong khoảng 78%.
Đặc điểm sinh học của vi bào tử trùng EHP
Vi bào tử trùng thuộc họ bộ Enterocytozoonidae, ngành Microsporidia, bao gồm những ký sinh trùng đơn bào, chuyên biệt hóa trên các loài động vật, vật chủ kí sinh bao gồm con người, côn trùng và giáp xác (Vávara và Lukeš, 2013). Phần lớn các loài của ngành Microsporidia cư ngụ trên động vật thủy sản (Stentiford và ctv, 2013).
Từ khi được miêu tả từ năm 2009, nhóm vi bào tử trùng (Enterocytozoon-group microsporidia – EGM) đã được nghiên cứu và phân lập được nhiều chi kí sinh trùng (bao gồm Enterospra, Nucleospora, Desmozoon, Obruspora và Hepatospora). Chúng có tầm ảnh hưởng lớn lên cả vật chủ có xương sống và không có xương sống, bao gồm con người và đa dạng các quần xã (Stentiford và ctv, 2019).
Tất cả các vi bào tử trùng bao gồm EHP đều có giai đoạn bào tử (có thể trong tế bào hoặc ngoài tế bào) và giai đoạn sinh sôi, phát triển trong tế bào (có nhiều giai đoạn nhỏ) [hình 2].
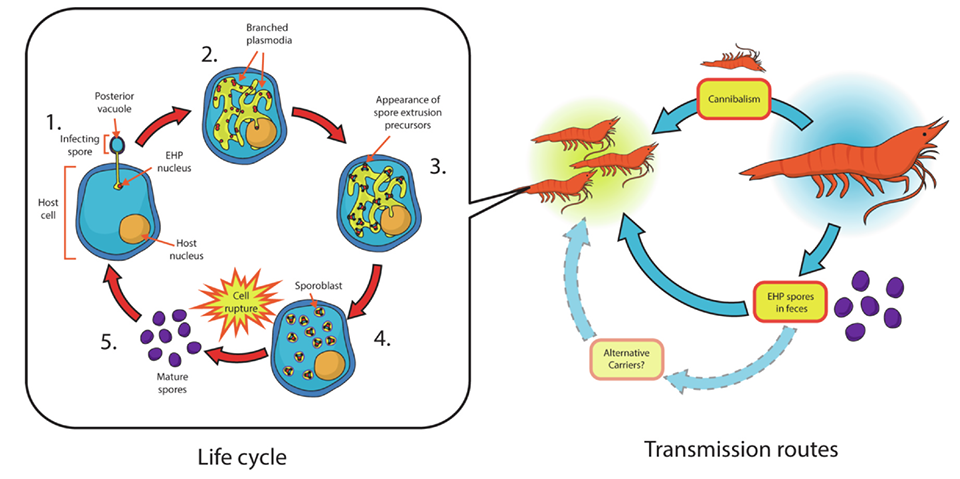
Hình 2: Vòng đời và con đường truyền nhiễm của EHP. Ảnh: Chajarasphong và ctv, 2020.
(1) Bào tử nảy mầm, bào tử đâm và màng tế bào vật chủ bằng ống polar và đưa vật chất di truyền vào trong tế bào chất.
(2) Các bào tử phát triển và qua các lần phân chia trở thành một nhánh plasmodium.
(3) Hình thành trong nhánh plasmodium các tiền chất giúp cho quá trình sinh bào tử .
(4) Plasmodium bị phân cắt ra thành tiền bào tử.
(5) Tế bào chủ vỡ ra và giải phóng các bào tử trưởng thành.
Các con đường truyền nhiễm
Trong ao nuôi tôm, EHP lây lan theo chiều ngang bởi việc ăn vào các bào tử thông qua con đường fecal-oral hoặc tạp tính ăn đồng loại của tôm khỏe với tôm bị nhiễm bệnh [hình 2] (Tangprasittipap và ctv, 2013; Tang và ctv, 2016). Sự truyền nhiễm qua con đường fecal-oral được chứng minh bằng thí nghiệm chia tôm bệnh và tôm khỏe thông qua lồng lưới kết quả tôm khỏe vẫn bị nhiễm bệnh do bào tử được truyền theo đường phân đi vào trong nước (Salachan và ctv, 2017).
Lây truyền theo chiều dọc của EHP cũng được báo cáo bởi Vu Khac và ctv (2018), tiến hành thực hiện PCR trên nauplii, zoeae giai đoạn 1 và zoeae giai đoạn 2, từ tôm mẹ bị nhiễm EHP, đều cho kết quả dương tính với EHP. Thật không may, tuyên bố này không đi kèm với một cuộc kiểm tra mô học rõ ràng. Giai đoạn của nauplii cũng không được báo cáo, có thể là do nhiễm trùng do ăn phải các bào tử thải ra trong phân của động vật bố mẹ chứ không phải qua tế bào tuyến sinh dục. Tiềm năng lây truyền theo chiều dọc của ký sinh trùng khác của ngành microsporidians đã được báo cáo với sự xuất hiện của chúng trong mô tuyến sinh dục (Stentiford et al., 2013b).
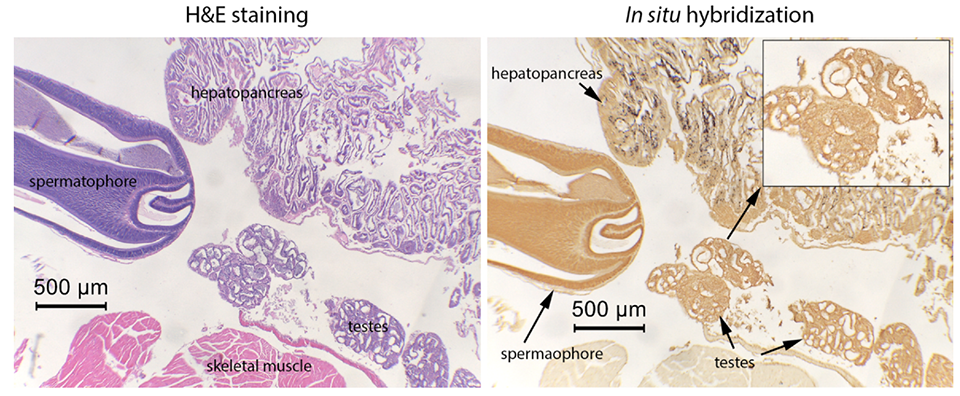
Hình 3. Ảnh của mẫu nhuộm H&E và ISH ở tôm đực nhiễm EHP cho thấy không có sự xuất hiện của vi bào tử trùng trong tinh nang của tôm trong khi gan tụy bị nhiễm nặng. (dấu đen là vi bào tử trùng) Ảnh: Chaijarasphong và ctv, 2020.
Tuy nhiên, khi thực hiện kĩ thuật lai tại chỗ ( in situ hybridization – ISH) trên tôm giống (juvenile shrimp) và tôm bố mẹ cho kết quả dương tính với EHP xuất hiện trong gan tụy nhưng trong tinh nang và buồng trứng của mẫu không có, điều này làm cho việc truyền qua tuyến sinh dục khó xảy ra [hình 3]. Dù vậy, vì thí nghiệm này không được thực hiện một cách toàn diện bằng cách sử dụng số lượng mẫu lớn hơn và tất cả các giai đoạn sống, nên ở giai đoạn này không thể loại trừ khả năng lây truyền EHP theo chiều dọc.
Biện pháp phòng ngừa bệnh trong trại giống
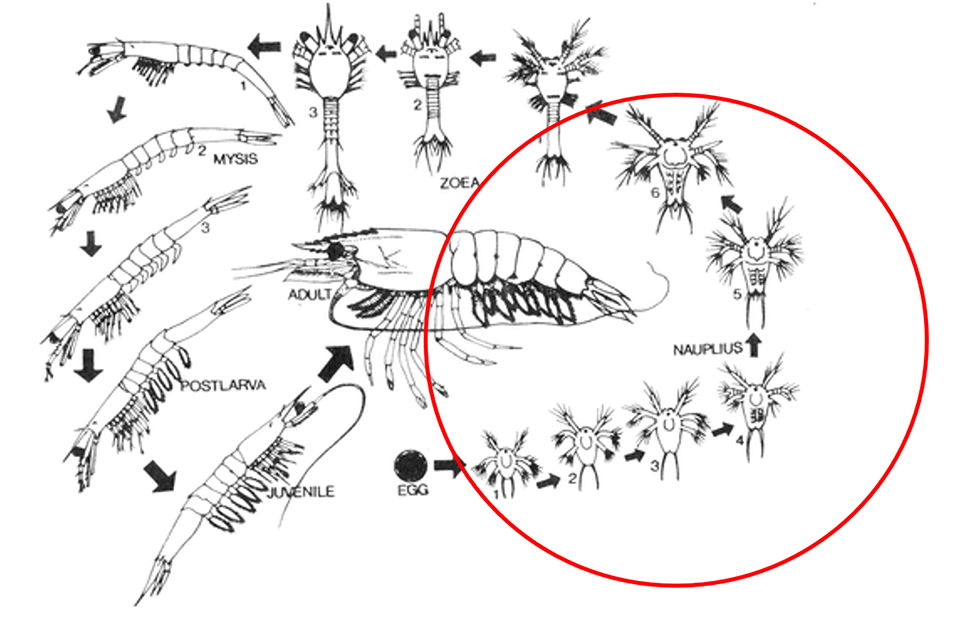
Hình 4. Vòng đời của tôm he. (vòng đỏ là giai đoạn nauplii từ N1 đến N6)
Thậm chí nếu không lây truyền theo chiều dọc thì tôm bố mẹ bị nhiễm EHP vẫn có thể lây cho con của chúng bằng việc thải bào tử thông qua phân trong bể ở trại nuôi. Nauplii có khả năng bị nhiễm khi chúng đến giai đoạn N6 do bắt đầu ăn phiêu sinh thực vật, việc làm sạch trước sớm trong giai đoạn nauplii từ N1 đến N6 có thể giúp giảm việc truyền nhiễm bệnh. Việc này đã được chứng minh thành công trong việc kiểm soát baculovirus gây hoại tử tuyến ruột giữa (Baculovirus midgut gland necrosis virus – BMNV) (Momoyama, 1992) và vi-rút gây bệnh còi trên tôm sú (Monodon baculovirus – MBV) (Chen và ctv, 1992).

_1772730767.png)







_1769663497.jpg)
_1768458979.jpg)
_1768297695.jpg)
_1766652211.jpg)
_1772730767.png)



_1772608222.png)


