Những nghiên cứu mới nhất về nguyên nhân bệnh Phân trắng
Trước đây, mối liên hệ giữa các yếu tố này đã được nghiên cứu và khẳng định có liên quan mật thiết đến các biểu hiện bệnh lý của tôm bị WFS (Sriurairatana và cộng sự, 2014). Những sinh vật gây bệnh này là một tập hợp các sinh vật liên quan đến vật chủ (bao gồm sinh vật nhân sơ, sinh vật nhân chuẩn và vi rút) có khả năng gây suy giảm sức khỏe do sự tương tác giữa chúng (Bass và cộng sự, 2019). Ở đây, WFS được coi là một bệnh có dấu hiệu rối loạn sinh lý do sự chuyển đổi của hệ vi sinh vật của vật chủ thành hệ vi sinh vật gây bệnh trong đường tiêu hóa (GI), trong đó các thành phần nhân sơ và nhân chuẩn của nó là Vibrio spp. và EHP.
Do đó, nhiều nghiên cứu sâu rộng đã được thực hiện về sự biểu hiện của WFS trong điều kiện phòng thí nghiệm nhằm cung cấp thông tin chuyên sâu về mối liên hệ giữa WFS, EHP và Vibrio spp., (Aranguren Caro và cộng sự, 2021, Sathish Kumar và cộng sự, 2022). Gần đây, người ta phát hiện ra rằng hầu hết Vibrio spp. ở tôm thẻ trắng bị bệnh đường ruột thuộc dòng V. harveyi (Munkongwongsiri et al., 2022). Ngoài ra, một số nghiên cứu khác lại chỉ ra rằng V. alginolyticus là chủng phân lập chiếm ưu thế từ ruột tôm bị ảnh hưởng bởi WFS (Kumara và Hettiarachchi, 2017, Sathish Kumar và cộng sự, 2022). Tuy nhiên, không có quan sát lâm sàng nào được thực hiện về tác dụng cộng hưởng của EHP với V. harveyi và V. alginolyticus ở tôm thẻ.
Nhóm nghiên cứu của Subash và cs (2023) đã điều tra mối liên quan giữa EHP và hai loài Vibrio spp. (V. harveyi và V. alginolyticus) ở tôm thẻ chân trắng trong điều kiện phòng thí nghiệm. Hệ vi sinh vật đường ruột là thành phần cơ bản cho sự phát triển, dinh dưỡng, khả năng miễn dịch, khả năng kháng mầm bệnh và duy trì cân bằng nội môi bình thường của tôm.
Thí nghiệm sự cộng hưởng của EHP và Vibrio spp.
Mẫu tôm bị bệnh có phân trắng, chậm tăng trưởng, kích thước khác nhau và hội chứng bong vỏ (8 ± 2 g) được thu thập từ một trang trại nuôi tôm ở huyện Ramanathapuram, Tamil Nadu, Ấn Độ và được vận chuyển trong điều kiện sống đến phòng thí nghiệm. Sau đó, các mẫu tôm được đặt trong nước đá để gây mê và được phẫu thuật để thu thập các mô mục tiêu để sàng lọc Enterocytozoon hepatopenaei (EHP) và các bệnh khác được liệt kê trong WOAH (Bảng 1). Gan tụy từ tôm nhiễm EHP dương tính với phản ứng chuỗi polymerase (PCR) đã được thu thập và xử lý để tinh chế bào tử EHP sẽ được sử dụng cho thử nghiệm thử nghiệm. Một lô tôm khỏe khác (10 ± 1 g) được sử dụng cho thí nghiệm cảm nhiễm được lấy từ Cơ sở Trang trại Nghiên cứu Nuôi trồng Hải sản, Đại học Thủy sản Tamil.
| Bệnh | Cơ quan mục tiêu | KQ PCR |
| Enterocytozoon hepatopenaei (EHP) | Gan tụy | + |
| Bệnh hoại tử gan tụy cấp tính (Acute Hepatopancreatic Necrosis Disease - AHPND) | Các mô liên quan đến ruột (Gan tụy & Ruột) | - |
| Bệnh đầu vàng (Yellow Head Virus- YHV) | Cơ quan lympho, ruột | - |
| Virus hoại tử dưới da và tạo máu truyền nhiễm (Infectious Hypodermal and Haematopoietic Necrosis Virus - IHHNV) | Mang | - |
| Virus hoại tử cơ truyền nhiễm (Infectious Myonecrosis Virus - IMNV) | Cơ | - |
| Viêm và hoại tử gan tụy (Necrotising Hepatopancreatitis - NHP) | Gan tụy | - |
| Hội chứng Taura Virus (Taura syndrome Virus - TSV) | Cơ, mang, cơ quan Lympho | - |
| Bệnh đốm trắng (White spot Syndrome Virus - WSSV) | Mang, phụ bộ | - |
Tôm thẻ chân trắng (10 ± 1 g) được nuôi thích nghi với điều kiện phòng thí nghiệm trong hai bể nhựa thể tích 500L với điều kiện chất lượng nước tối ưu, cụ thể: oxy hòa tan ∼ 5 ppm, độ mặn − 35 ppt, pH – 8,0, nhiệt độ – 26 ± 2 °C, độ kiềm ∼ 80 ppm, amoniac ∼ 0,05 ppm, nitrat < 0,2 ppm và nitrit – 0, với sục khí và cho ăn thích hợp. Sau đó, tôm được chia thành 8 nhóm (A, B, C, D, E, F, G và H), mỗi nhóm có 10 cá thể tôm với ba lần lặp lại. Bố trí thử nghiệm của các bể được tóm tắt trong Hình 1. Nhóm A được duy trì ở nhóm đối chứng khỏe mạnh được cho ăn thức ăn viên thông thường. Tôm ở các nhóm B, C, D và E được cho ăn bằng thức ăn dạng viên bổ sung EHP (∼1,67 × 106 bào tử/g thức ăn) ở mức 5% trọng lượng/ngày trong 5 ngày (5 lần/ngày).
Nhóm F, G và H được cho ăn thức ăn viên thông thường. Sau khi cho ăn trong 5 ngày, ba con tôm từ mỗi lần lặp lại của nhóm B, C, D và E đã được xác nhận có sự nhiễm EHP bằng phương pháp khuếch đại PCR. Sau khi xác nhận thành công, tôm ở tất cả các nhóm ngoại trừ A và B được cho vào bể ngâm với chất cấy vi khuẩn tương ứng trong 2 giờ (Hình 1) vì thời gian dài hơn có thể dẫn đến sự nhân lên của vi khuẩn gây ra tỷ lệ chết cực cao và nhanh chóng (Robertson và cộng sự, 1998). Do đó, chất cấy vi khuẩn từ 10 mL nước muối (∼5 × 107 CFU/mL) đã được thêm vào 5 L nước nuôi để đạt được nồng độ cuối cùng là ∼ 1 × 105 CFU/mL cho thí nghiệm cảm nhiễm vi khuẩn. Sau cảm nhiễm, tôm ở tất cả các nhóm được cho ăn thức ăn viên bình thường với khẩu phần đều đặn trong suốt thí nghiệm.
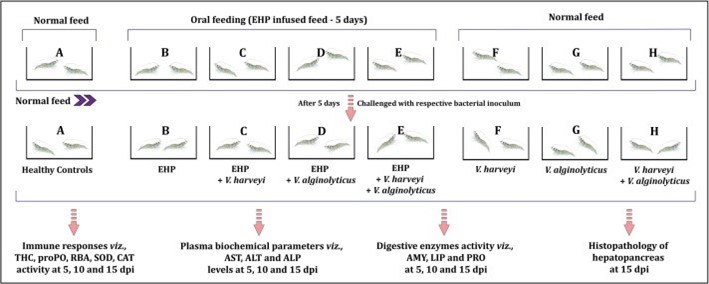
Hình 1. Bố trí thí nghiệm hiển thị các nghiệm thức khác nhau cho thí nghiệm
Tôm thí nghiệm cảm nhiễm được kiểm tra hàng ngày trong 15 ngày sau khi nhiễm bệnh (dpi) để tìm bằng chứng về phân trắng, thay đổi hành vi, kiểu ăn, làm đầy ruột, màu sắc, độ trương của gan tụy và tỷ lệ chết. Để phân tích các thông số miễn dịch, các mẫu máu được thu thập từ ba con tôm trong mỗi bể với tốc độ 5,10 và 15 dpi qua xoang bụng của phần đầu ngực bằng cách sử dụng ống tiêm 2 mL có kim cỡ 26 chứa 50 μL dung dịch chống đông máu (100) mM glucose, 30 mM trisodium citrate, 26 mM axit xitric, 510 mM NaCl và 10 mM EDTA.Na2: pH = 7,3). Để phân tích sinh hóa, một phần mẫu tan máu ngay lập tức được ly tâm ở tốc độ 12.000 × g trong 20 phút và phần nổi phía trên được thu thập và bảo quản ở -20 ° C cho đến khi phân tích. Để đánh giá hoạt động của enzyme tiêu hóa, gan tụy của tôm được đồng nhất hóa trong 1,5 mL dung dịch muối đệm photphat, ly tâm ở tốc độ 15493 × g (Sigma 3 k18, Rotor số 12154) trong 5 phút ở 4°C, phần nổi phía trên không chứa chất béo là sau đó được loại bỏ và bảo quản ở -20°C cho đến khi phân tích.
Kết quả thí nghiệm cảm nhiễm
Khi bắt đầu thí nghiệm, không quan sát thấy dấu hiệu nhiễm trùng bất thường nào ở tôm. Sau 5 dpi, tôm trong nhóm E bị cảm nhiễm với EHP và cả vi khuẩn (V. harveyi và V. alginolyticus) đều có ruột trắng (Hình 2A) và bắt đầu thải ra các sợi phân màu trắng vàng (Hình 2 B). Ruột đỏ và thoái hóa (Hình 2C) đã được quan sát thấy ở những con tôm được cảm nhiễm với EHP và V. alginoloyticus (D) trong khi những con tôm được cảm nhiễm với EHP và V. harveyi (C) có ruột bình thường. Trong khi đó, tôm ở nhóm H được cảm nhiễm với cả hai loại vi khuẩn không có EHP cho thấy đường ruột bình thường với gan tụy bị teo lại. Ngoài ra, không quan sát thấy đường ruột bất thường ở tôm được cảm nhiễm chỉ với EHP (B), chỉ riêng V. harveyi (F), chỉ riêng V. alginolyticus (G) và đối chứng không bị nhiễm bệnh (A). Lên đến 15 dpi, tôm ở tất cả các nhóm tiếp tục có kiểu đường ruột tương tự nhau.

Hình 2. Những thay đổi quan sát được ở ruột tôm khi thực hiện cảm nhiễm
A – Ruột giữa màu trắng nhìn thấy được qua lớp biểu bì trong suốt (mũi tên) ở nhóm E.
B – Các sợi phân màu trắng vàng do tôm thải ra (mũi tên) nhóm E.
C – Ruột màu đỏ được quan sát thấy ở nhóm D.
Kết quả về các thông số miễn dịch
Tổng số lượng tế bào máu (THC)
Sự phơi nhiễm của tôm thẻ khỏe mạnh với các sự kết hợp khác nhau của EHP và Vibrio spp. đã thay đổi tổng số tế bào máu (P < 0,001) (Hình 3). Mức THC giảm đáng kể đã được quan sát thấy ở tất cả các nhóm được cảm nhiễm ở mức 5 dpi khi so sánh với nhóm đối chứng không bị nhiễm. Mức độ THC phục hồi đã được quan sát thấy ở các nhóm bị nhiễm Vibrio spp. một mình không có EHP (nhóm F, G và H). Ngược lại, mức THC trong nhóm B, C, D và E không được phục hồi ngay cả sau 10 hoặc 15 dpi và có xu hướng giảm giá trị của chúng.
Hoạt tính Prophenoloxidase (proPO)
Ở mức 5 dpi, nhóm G (riêng V. alginolyticus) (P < 0,05) chiếm ưu thế đáng kể về nồng độ proPO tan máu so với nhóm đối chứng và các nhóm khác (P < 0,001). Tuy nhiên, sau 10 dpi, nồng độ proPO tăng đáng kể (P < 0,05) ở nhóm E (EHP + V. harveyi + V. alginolyticus) so với các nhóm khác. Trong khi đó, nhóm G có mức proPO tăng trước đây đã đạt đến mức thấp hơn ở mức 10 và 15 dpi. Không có nhóm nào khác cho thấy proPO tăng đáng kể trong suốt thử nghiệm (Hình 3).
Hoạt động bùng nổ hô hấp (RBA)
So với đối chứng, nhịp hô hấp cao hơn đáng kể (P < 0,05) ở tôm bị cảm nhiễm ở mọi khoảng thời gian (P < 0,001) (Hình 3). Ở mức 5 dpi, RBA tăng rõ rệt được quan sát thấy ở nhóm B (riêng EHP), C (EHP + V. harveyi), G (riêng V. harveyi) và H (V. harveyi + V. alginolyticus). Mặt khác, nồng độ RBA thấp hơn hoặc không có thay đổi ở bất kỳ khoảng thời gian nào ở nhóm E (EHP + V. harveyi + V. alginolyticus) tạo ra phân trắng. Xu hướng vẫn không thay đổi cho đến 15 dpi.
Hoạt tính Superoxide dismutase (SOD)
Trong suốt thử nghiệm, có sự dao động đáng kể (P < 0,05) về mức SOD giữa các nhóm được cảm nhiễm khác nhau khi so sánh với nhóm đối chứng (P < 0,001) (Hình 3). Nhìn chung, mức SOD trong tất cả các nhóm cao hơn đáng kể (P < 0,05) ở mức 5 dpi ngoại trừ nhóm E (EHP + V. harveyi + V. alginolyticus) cũng cho thấy hoạt động SOD tăng lên ở mức 10 dpi.
Hoạt tính Catalase (CAT)
Hoạt động CAT trong các nhóm khác nhau thay đổi đáng kể trong từng khoảng thời gian (P <0,001) (Hình 3). Hoạt động CAT cao hơn đáng kể (P <0,05) được quan sát thấy đầu tiên ở nhóm E ở mức 5 dpi khi so sánh với các nhóm khác. Ở mức 10 dpi, tất cả các nhóm khác cũng có mức CAT cao hơn đáng kể so với nhóm đối chứng. Tuy nhiên, mức độ dường như giảm ở mức 15 dpi.
Kết quả về thông số sinh hóa huyết tương
Aspartate aminotransferase (AST)
Nồng độ AST trong huyết tương bị ảnh hưởng đáng kể ở các nghiệm thức khác nhau ở các khoảng thời gian khác nhau (P <0,001) (Hình 4). Trong quá trình lây nhiễm, nồng độ AST cao hơn đáng kể (P < 0,05) ở những cá thể tôm bị nhiễm cả EHP và Vibrio spp. trong đó nhóm E có mức độ cao nhất khi so sánh với nhóm đối chứng. Trong khi tôm bị cảm nhiễm với Vibrio spp. riêng (nhóm F, G và H) duy trì mức AST của họ ở mức bình thường với sự kiểm soát ở mọi khoảng thời gian.
Alanine aminotransferase (ALT)
Tương tự như AST, sự thay đổi đáng kể về nồng độ ALT huyết tương chỉ được nhận thấy ở những cá thể tôm nhận được cảm nhiễm cả EHP và Vibrio spp. (P <0,001) (Hình 4). Nhóm B, C, D và E thể hiện sự gia tăng ALT ở mức 5 dpi, cao hơn rất nhiều ở nhóm E. Xu hướng tăng không đáng kể ở mức 10 dpi, sau đó mức độ giảm đi một chút nhưng vẫn cao hơn so với nhóm đối chứng. Một lần nữa, không có sự thay đổi đáng kể nào về mức ALT có thể được quan sát thấy ở các nhóm F, G và H khi so sánh với nhóm đối chứng.
Phosphatase kiềm (ALP)
Mức ALP huyết tương phản ánh sự thay đổi tương tự như ALT. Nhóm B, C, D và E cho thấy mức ALP ban đầu tăng ở mức 5 dpi, khi quá trình lây nhiễm tiến triển. Nhóm E cho thấy mức tăng hơn nữa ở mức 10 dpi và cả bốn nhóm này đều duy trì mức ALP tương tự ở mức 15 dpi và cao hơn đáng kể khi so sánh với đối chứng (P <0,001) (Hình 4). Mức ALP ở nhóm F, G và H không thay đổi đáng kể.
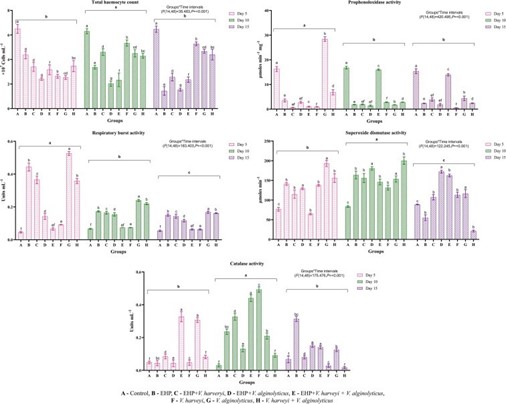
Hình 3. Kết quả về phản ứng miễn dịch ở tôm trong thí nghiệm
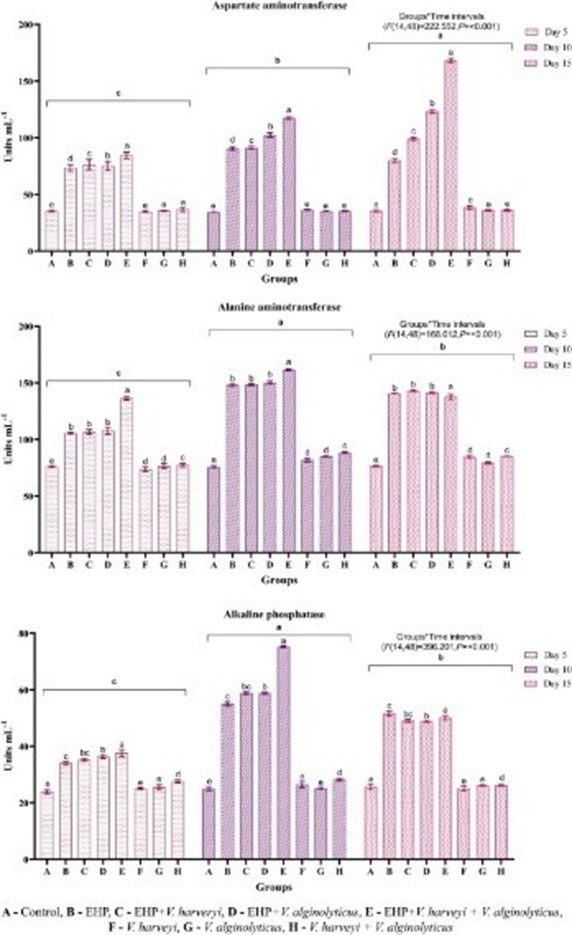
Hình 4. Những thay đổi về thông số sinh hóa huyết tương ở tôm trong thí nghiệm.
Các thanh dọc với các bảng chữ cái khác nhau (a,b,c…) khác nhau đáng kể (P < 0,05) theo nhóm ở các khoảng thời gian khác nhau.
Kết quả về hoạt động của enzyme tiêu hóa
Alpha-amylase (AMY)
Sự suy giảm đáng kể (P < 0,05) về hoạt động của AMY đã được quan sát thấy trong đường tiêu hóa của tôm trong số các nhóm được cảm nhiễm kết hợp với EHP và Vibrio spp. (B, C, D và E) ở mức 5 dpi và không thay đổi ở mức tối đa 15 dpi khi so sánh với đối chứng (P < 0,001) (Hình 5). Trong mọi trường hợp, không có thay đổi đáng kể nào được ghi nhận ở các nhóm tôm (F, G và H) bị cảm nhiễm không có EHP. Trong khi đó, Tôm ở lô đối chứng duy trì hoạt động enzyme bình thường trong suốt thí nghiệm.
Lipase (LIP)
Đã quan sát thấy sự khác biệt rõ ràng trong hoạt động LIP giữa các nhóm được cảm nhiễm tại mỗi thời điểm lấy mẫu (P <0,001) (Hình 5). Ở mức 5 dpi, mức LIP được nhận thấy tăng đáng kể (P < 0,05) ở những cá thể tôm thải ra phân trắng (nhóm E). Ngược lại, nhóm B (riêng EHP) có mức LIP tiêu hóa giảm đáng kể (P < 0,05) khi so sánh với nhóm đối chứng. Xu hướng này tiếp tục cho đến 15 dpi và nhóm E chỉ có mức LIP cao hơn đáng kể so với tất cả các nhóm khác. Ngoài ra, mức độ tiếp tục giảm ở nhóm B. Mặt khác, nhóm C và D gặp phải sự mất cân bằng về hoạt động LIP còn nhóm F, G và H vẫn duy trì hoạt động.
Protease (PRO)
Như được thấy trong Hình 5, hoạt động PRO trong tuyến tiêu hóa của tôm giảm đáng kể (P < 0,05) khi bị cảm nhiễm cùng với EHP (nhóm B, C, D và E) bắt đầu từ 5 dpi khi so sánh với đối chứng. Trong đó, hoạt tính được nhận thấy giảm nhiều ở nhóm E và theo sau là mức giảm tương tự khi lấy mẫu tiếp theo ở mức 10 và 15 dpi. Không có sự thay đổi đáng kể nào về mức độ PRO của các nhóm được cảm nhiễm chỉ với vi khuẩn (nhóm F, G và H).
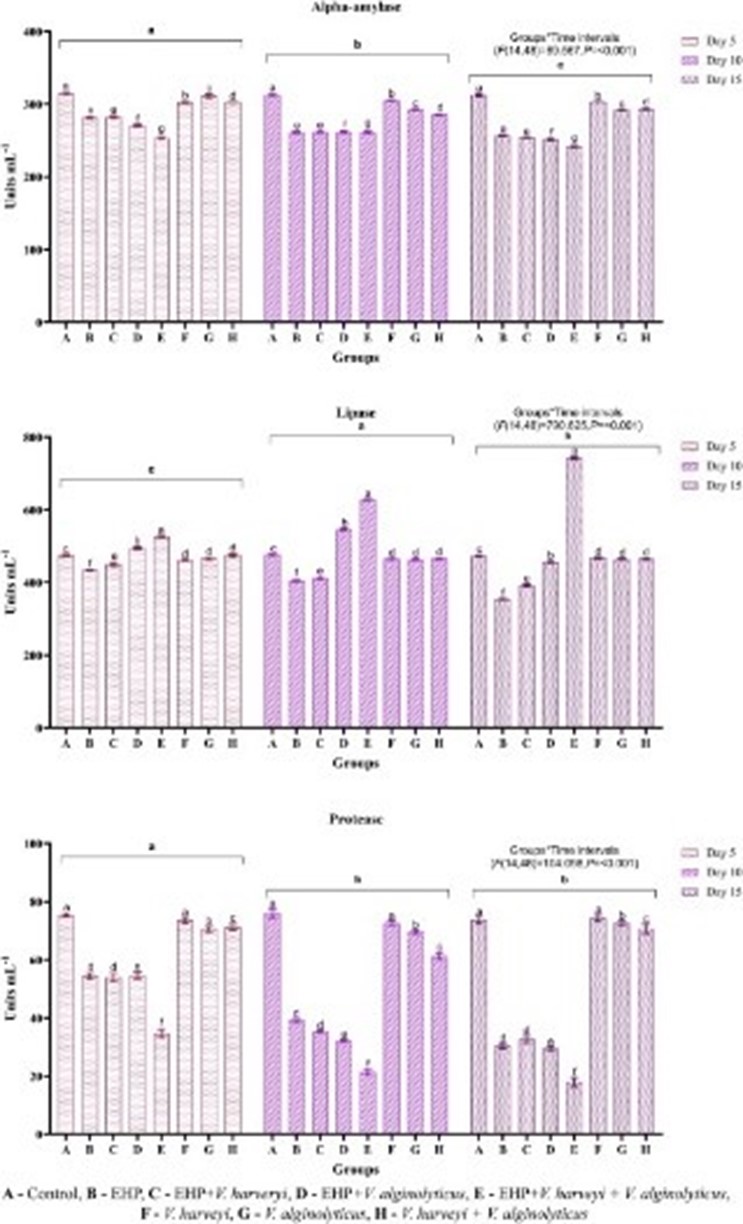
Hình 5: Hoạt động của enzyme tiêu hóa ở tôm trong thí nghiệm.
Các thanh dọc với các bảng chữ cái khác nhau (a,b,c…) khác nhau đáng kể (P < 0,05) theo nhóm ở các khoảng thời gian khác nhau.
Kết quả phân tích Mô bệnh học
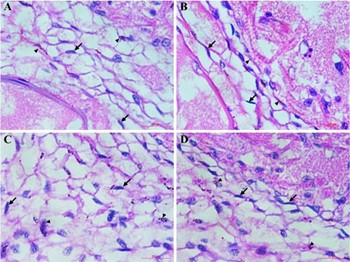
Lớp biểu mô ống bao gồm các bào tử EHP trưởng thành, sự bong tróc của các tế bào biểu mô ống, màng đáy tách ra và các giai đoạn phát triển được cho là của EHP cho thấy các thể vùi ưa kiềm thường được quan sát thấy ở các nhóm B, C, D và E (Hình 6A & 6B). Ở những con tôm có phân trắng (nhóm E), lượng không bào lipid tăng lên cũng được tìm thấy trong lòng ống gan tụy (Hình 6C & 6D). Các khối vi khuẩn cùng với nhiễm trùng EHP đã dẫn đến bong tróc (Hình 7 A), bong tróc (Hình 7B, 7C & 7D) và kết tụ (Hình 7C & 7D) của các lớp vi nhung mao để tạo thành cấu trúc ATM trong nhóm E (Hình 2). 7E & 7F). Ngoài ra, sự xâm nhập của vi khuẩn được cho là cùng tồn tại với bào tử EHP đã được ghi nhận ở gần vùng ruột giữa của gan tụy trong nhóm E (Hình 8).
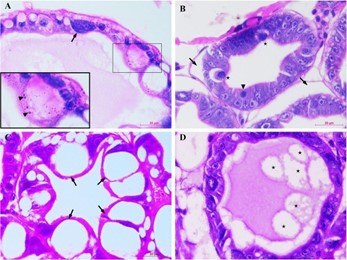
Hình 6. Ảnh vi mô về những thay đổi mô bệnh học ở gan tụy đến biểu hiện thực nghiệm của hội chứng phân trắng ở P. vannamei (H&E).

Hình 7. Mô học của gan tụy cho thấy sự phát triển của cấu trúc ATM ở nhóm E (H&E).
_1703477249.jpg)









_1769663223.jpg)

_1769399561.jpg)
_1762138517.jpg)







