Cụ thể, trong chẩn đoán bệnh hoại tử gan tụy cấp tính (AHPND) gồm các kỹ thuật thường được dùng như quan sát các dấu hiệu lâm sàng, mô bệnh học, phương pháp dựa trên PCR, phương pháp LAMP, xét nghiệm miễn dịch nhắm mục tiêu protein PirAvp và PirBvp, phân lập và nhận dạng vi khuẩn hay xác định khả năng gây bệnh của các chủng phân lập.
Các phương pháp chẩn đoán động vật thủy sản có thể được phân loại thành ba cấp độ. Bao gồm, cấp độ I là những quan sát về hành vi của động vật và kiểm tra các dấu hiệu lâm sàng tổng thể. Cấp độ II là sự phân lập và kiểm tra mầm bệnh về ký sinh trùng, vi khuẩn học và nấm học và đánh giá mô bệnh học của vật chủ bị nhiễm bệnh. Cấp độ III bao gồm phân lập vi khuẩn/virus, nuôi cấy, kiểm tra bằng kính hiển vi điện tử và các kỹ thuật phân tử (PCR, LAMP, xét nghiệm miễn dịch).
Quan sát dấu hiệu lâm sàng (Cấp độ I): Sự khởi đầu của các dấu hiệu lâm sàng là tỷ lệ chết thường bắt đầu trong vòng 30-35 ngày sau khi thả giống trong ao thâm canh, hay sớm hơn. Tỷ lệ tử vong dao động từ 40–100 phần trăm. Các dấu hiệu lâm sàng bao gồm gan tụy nhạt màu đến trắng, teo, dạ dày và ruột trống rỗng, đốm đen hoặc các vệt có thể nhìn thấy trong gan tụy (do các ống bị melan hóa) và vỏ mềm ở giai đoạn mãn tính của bệnh. Ngoài ra, gan tụy dai (có thể do tăng mô liên kết xơ và tích tụ tế bào máu).
Phân tích phòng thí nghiệm (Phân lập vi khuẩn, mô bệnh học - Cấp độ II): Khi có dấu hiệu đầu tiên của bệnh, các mẫu bệnh phẩm (gan tụy tôm, tôm nguyên con, mẫu phân hoặc phân lập vi khuẩn) nên được gửi đến các phòng thí nghiệm (lab). Bất cứ khi nào có thể, tôm có dấu hiệu lâm sàng của bệnh nên được chọn để lấy mẫu. Cỡ mẫu phải lấy đại diện cho quần đàn trong ao nuôi, và đủ số lượng mẫu cho từng phương pháp phân tích tại phòng thí nghiệm. Chất lượng của các mẫu vật là quan trọng và chúng phải được bảo quản, lưu trữ và vận chuyển đúng cách đến tránh sự phân hủy DNA. Các mô cố định có thể được xử lý mô học; các mô được bảo quản bằng ethanol hoặc đông lạnh có thể được sử dụng để phân tích PCR (hoặc qPCR).
Phân lập vi khuẩn để phát hiện VpAHPND từ các mẫu cận lâm sàng, mẫu tôm (gan tụy hoặc PL) hoặc các mẫu môi trường có thể được thực hiện thông qua việc sử dụng bất kỳ phương pháp thích hợp nào. Nhận dạng hình thái khuẩn lạc vi khuẩn trên môi trường nuôi cấy. Định danh đến loài có thể được thực hiện bằng thử nghiệm API Rapid NE, giải trình tự 16S rRNA hoặc nhắm vào các gen mục tiêu để thực hiện PCR. Những vi khuẩn này có thể được lưu trữ ở -80°C trong TSB+ được bổ sung glycerol vô trùng.

Phân lập vi khuẩn để phát hiện VpAHPND từ các mẫu cận lâm sàng, mẫu tôm (gan tụy hoặc PL)
Để đánh giá mô học, tôm nên được cố định trong Davidson’s (cồn-formalin-axit axetic) trong 24–48 giờ (tùy thuộc vào cỡ tôm) rồi chuyển đến 70 phần trăm ethanol để lưu trữ. Sau đó được xử lý thành các khối parafin và cắt thành những lát mỏng dán lên lame kính. Các phần mô sau đó sẽ được nhuộm bằng H&E, các phần nhuộm màu sau đó được kiểm tra bằng kính hiển vi.
Ở giai đoạn đầu của bệnh, kiểm tra mô học cho thấy các ống gan tụy (HP) bắt đầu thoái hóa, tròn lại và bong ra trong lòng của chúng. Sự bong tróc do VpAHPND gây ra có thể là do ảnh hưởng của độc tố PirABvp đối với các protein tế bào (chẳng hạn như vi ống và sợi actin) liên quan đến sự gắn kết của tế bào với màng. Một số tế bào biểu mô biểu hiện nhân to rõ rệt (karyomegaly); phản ứng viêm không rõ ràng ở giai đoạn này.
Ở giai đoạn cấp tính, bệnh lý được đặc trưng bởi sự thoái hóa dần dần của các ống HP từ đầu gần đến đầu xa, làm tròn đáng kể và bong tróc ồ ạt các tế bào biểu mô HP vào trong lòng, rối loạn chức năng của các tế bào B (Blastozellen), F (Fibrillenzellen) và R (Restzellen) và thiếu hoạt động phân bào trong các tế bào E (Embryozellen).
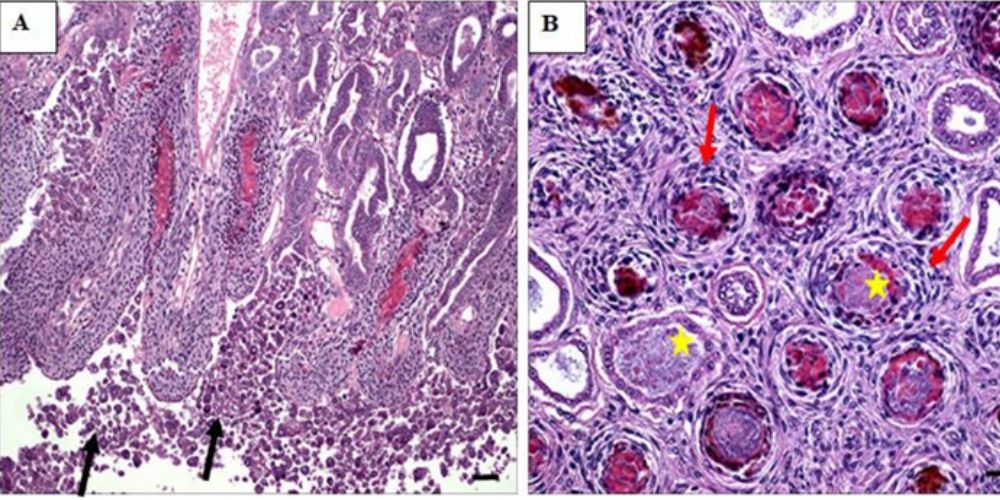
Bệnh được đặc trưng bởi sự thoái hóa dần dần của các ống HP từ đầu gần đến đầu xa
Kỹ thuật phân tử (Cấp độ III): (a) Phương pháp dựa trên PCR được thực hiện trên gen độc tố AHPND pirAvp và pirBvp trong các mẫu. Chi tiết về cách thực hiện các thử nghiệm này có thể được tìm thấy trong các ấn phẩm gốc và trong sổ tay OIE Aquatic (OIE, 2019).
Hay các bộ dụng cụ PCR và qPCR để phát hiện gen pirAvp và pirBvp cũng có sẵn thương mại. (b) Phương pháp khuếch đại đẳng nhiệt tuần hoàn (LAMP), giới hạn phát hiện của hầu hết các phương pháp PCR một bước thường là khoảng 104 CFU/mL VpAHPND vi khuẩn. AHPND LAMP được chứng minh là nhạy hơn 100 lần, vì phương pháp này sử dụng bốn đoạn mồi (do đó cũng cung cấp độ đặc hiệu cao hơn so với phương pháp PCR một bước thông thường) để tạo ra số lượng lớn các sản phẩm khuếch đại.
Các sản phẩm khuếch đại AHPND LAMP thường được phát hiện bằng trực quan với điện di trên agarose gel; tuy nhiên phương pháp này có nguy cơ cao nhiễm từ việc mở các ống phản ứng cho điện di. Có thể được kết hợp với đầu dò ssDNA được liên kết các hạt nano vàng và điều này có khả năng phát hiện giới hạn 100 CFU của VpAHPND. LAMP này có ưu điểm là xét nghiệm nhanh (50 phút) và hiệu suất cao, tính đặc hiệu và dễ thực hiện. (c) Xét nghiệm miễn dịch Các kháng thể đơn dòng (MAb) đã được tạo ra để chống lại các protein PirAvp và PirBvp được tiết ra trong dung dịch nuôi vi khuẩn. Các MAb này có thể được được sử dụng để phát hiện VpAHPND (thấp tới 1 CFU/mL) ở định dạng chấm điểm với HP tôm sau khi làm giàu vi khuẩn trong TSB+ trong 6 giờ.
_1686109037.jpg)



_1772124797.png)





_1769663497.jpg)
_1768458979.jpg)
_1768297695.jpg)
_1766652211.jpg)

_1771908780.jpg)
_1771901893.png)




