Khởi đầu từ những năm 2000, nghề nuôi cá rô đồng thâm canh phát triển mạnh ở lưu vực sông La Ngà thuộc tỉnh Đồng Nai. Năng suất nuôi có thể đạt 80-100 tấn/ha với cỡ cá thu hoạch 10-12con/kg. Sau đó, phong trào nuôi cá rô đồng phát triển dần đến các tỉnh Đồng Bằng Sông Cửu Long. Kể từ khi kỹ thuật sản xuất giống nhân tạo cá rô trở nên phổ biến và đặc biệt với giống cá rô "đầu vuông" (A. testudineus) sinh trưởng nhanh với năng suất rất cao, nghề nuôi cá rô phát triển nhanh đến các tỉnh Hậu Giang, Long Xuyên và thành phố Cần Thơ trong khoảng hai năm trở lại đây. Năng suất nuôi cá rô đầu vuông thâm canh hiện nay có thể đạt 150-200 tấn/ha (cỡ cá thu hoạch 5-8 con/kg) với mật độ nuôi lên đến 70-150 con/m2.
Với sự phát triển nhanh của các vùng nuôi cũng như mật độ nuôi cao như hiện nay, dịch bệnh thường xuyên xảy ra và gây thiệt hại kinh tế lớn cho người nuôi là điều khó tránh khỏi. Cá rô đồng nuôi thường bị các bệnh như "đóng nhớt, đen thân, mủ gan”. Tên của các bệnh này do người nuôi gọi theo biểu hiện của cá bệnh. Tỷ lệ cá chết sau các đợt dịch bệnh khá cao trong cả giai đoạn ương giống và nuôi thương phẩm, đặc biệt đối với bệnh đen thân. Cá trong ao có thể hao hụt lên đến 20% sau mỗi đợt cá bị bệnh này.
1. Các chỉ tiêu chất lượng nước tại ao nuôi:
Chất lượng nước là một yếu tố quan trọng trong nuôi trồng thủy sản, có ảnh hưởng rất lớn đến các quá trình biến đổi sinh lý và bệnh lý của cơ thể thủy sinh vật nói chung. Do đó trong quá trình thu mẫu chúng tôi cũng tiến hành đồng thời kiểm tra các chỉ tiêu về chất lượng nước (pH, DO, nhiệt độ, NH3) trong ao nhằm đánh giá khả năng ảnh hưởng của môi trường nước đến cá. Các chỉ tiêu môi trường được trình bày ở bảng 1.
Kết quả ở bảng 1 cho thấy các chỉ tiêu môi trường dao động trong khoảng thích hợp cho sự phát triển của cá rô đồng và không có sự bất thường nào về các chỉ tiêu môi trường nước tại các ao đang có bệnh xảy ra (Nguyễn Hữu Thịnh và ctv, 2011).
2. Triệu chứng và bệnh tích
2.1 Bên ngoài cơ thể
Trong cả hai lần thu mẫu, tất cả cá đều có trọng lượng trung bình khoảng 100-150g và đều có biểu hiện đen thân. Màu sắc trên cơ thể cá chuyển sang sậm hơn so với cá bình thường, cá thường nổi đầu, bơi lờ đờ và tấp gần mé bờ. Tỷ lệ phần trăm các loại biểu hiện bên ngoài của cá trong nghiên cứu được thể hiện thông qua bảng 2.
Kết quả ở bảng 2 cho thấy rằng cá chỉ có biểu hiện đen thân mà không kèm các triệu chứng khác chiếm đa số (82,5%), kế đến là đen thân và có kèm xuất huyết (12,5%) và cuối cùng là đen thân và có kèm vết loét (5%). Như vậy có thể thấy rằng đen thân là dấu hiệu bệnh chính của bệnh này (hình 1), xuất huyết hoặc có vết loét chỉ là những biểu hiện không điển hình (Nguyễn Hữu Thịnh và ctv, 2011).
2.2 Bên trong cơ thể
Gan sưng to có gờ không đồng nhất cùng với lách sưng nhũn và sẫm màu là các bệnh tích chiếm đa số trong đợt khảo sát cá bị đen thân tại An Giang (Nguyễn Hữu Thịnh và ctv, 2011).
3. Kết quả kiểm tra nấm và kí sinh trùng:
Khi quan sát tiêu bản tươi trên kính hiển vi và phân lập nấm trên môi trường GYA (Glucose yeast-extract agar) không cho kết quả xuất hiện các sợi nấm trên các mẫu cá rô bệnh đen thân. Như vậy, cá rô bị bệnh đen thân không do tác nhân nấm (Nguyễn Duy Khương 2011)
Những mẫu cá có biểu hiện đen thân được kiểm tra ký sinh trùng. Kết quả kiểm tra ký sinh về cường độ cảm nhiễm (CĐCN) và tỷ lệ cảm nhiễm (TLCN) của từng loại kí sinh trùng được trình bày bảng 3 (Nguyễn Hữu Thịnh và ctv, 2011)
Bảng 3: TLCN và CĐCN các loại ký sinh trùng ở 40 cá rô đen thân
Qua bảng 3 chúng tôi nhận thấy rằng tỷ lệ cảm nhiễm đối với Trypanosoma sp. cao nhất là 100%. Chúng có mặt ở máu của tất cả cá bị đen thân. Tiếp đến là Apiosoma sp. (trùng loa kèn) có tỷ lệ cảm nhiễm là 22,5%, Capollaria sp. (giun tròn) và Trichodina sp. (trùng bánh xe) có tỷ lệ cảm nhiễm lần lượt là 20% và 17,5%, cuối cùng là Myxobolus sp. (thích bào tử trùng) có tỷ lệ cảm nhiễm 15%. Các ký sinh trùng này được tìm thấy tại các vị trí ký sinh đặc trưng như trùng loa kèn chỉ được tìm thấy trên nhớt da của cá bệnh, trùng bánh xe và thích bào tử trùng trên nhớt mang, giun tròn trong lòng ruột, Trypanosoma sp. trong máu cá có biểu hiện đen thân. Đối với thích bào tử trùng, trùng bánh xe, trùng loa kèn, giun tròn, chúng sống ký sinh trên cơ thể cá chỉ có khả năng gây bệnh khi cảm nhiễm cao. Trong nghiên cứu này, cá chỉ nhiễm ký sinh trên với cường độ cảm nhiễm rất thấp do đó chúng không thể là nguyên nhân gây ra hiện tượng đen thân trên cá rô (Nguyễn Hữu Thịnh và ctv, 2011).
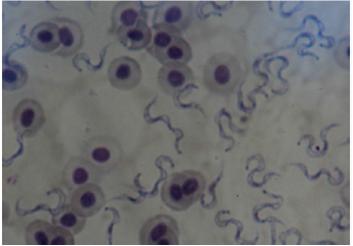
Hình 2: Trypanosoma sp. trong phết kính máu cá rô bị bệnh đen thân
Máu có vai trò quan trọng trong sự vận chuyển oxy, khi thiếu máu cơ thể sinh vật sẽ thiếu oxy. Trong quá trình thu mẫu cá tại ao, chúng tôi nhận thấy cá có hiện tượng nổi đầu. Kết quả kiểm tra Trypanosoma sp. ký sinh dày đặc trong máu cá hoàn toàn phù hợp với hiện tượng cá nổi đầu. Theo Lom (1979) và Khan (1985), thiếu máu là một trong những dấu hiệu lâm sàng thuộc về bệnh nhiễm Trypanosoma sp. Theo Bùi Quang Tề 2006, ký sinh trùng có khả năng tiết ra chất độc phá vỡ hồng cầu. Có thể thấy rằng việc phát hiện được Trypanosoma sp trên cá rô đen thân với tỷ lệ cảm nhiễm và cường độ cảm nhiễm cao là cơ sở quan trọng cho những nghiên cứu tiếp theo về biểu hiện đen thân trên cá rô cũng như tác hại của chúng đối với cá rô nuôi thâm canh (Nguyễn Hữu Thịnh và ctv, 2011).
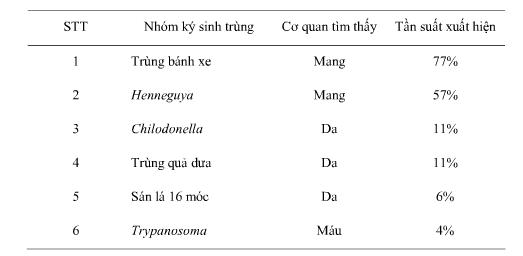
Theo nghiên cứu của Nguyễn Duy Khương (2011) trên cá rô đồng bị bệnh đen thân ngoài hai giống ký sinh trùng Trypanosoma và trùng bánh xe còn phát hiện thêm 4 giống ký sinh trùng khác là: Henneguya (thích bào tử trùng), Chilodonella (trùng miệng lệch), trùng quả dưa, sán lá 16 móc (bảng 4)
Bảng 4: Kết quả tỉ lệ nhiễm ký sinh trùng trên cá rô bệnh đen thân.
Hình 3: Henneguya ký sinh trên mang cá rô đồng.
4. Phân lập và định danh vi khuẩn:
Từ các mẫu cấy vi khuẩn trên các cơ quan gan, thận và lách của cá bị đen thân, 63 khuẩn lạc rời có màu trắng trong nhỏ li ti, vàng nhẵn lồi và khuẩn lạc tròn màu trắng sữa được cấy thuần cho việc định danh. Đây là các khuẩn lạc có số lượng ưu thế trên đường cấy.
Trong tổng số 63 chủng vi khuẩn phân lập được có 17,46% chủng vi khuẩn gram dương, 82,54% vi khuẩn gram âm, 17,46% là cầu khuẩn và 82,54% là trực khuẩn ngắn. Tất cả các chủng vi khuẩn gram dương thu được đều là cầu khuẩn có dạng chuỗi. Các chủng vi khuẩn gram âm đều là trực khuẩn ngắn.
63 chủng vi khuẩn thu được khi nuôi cấy trên BHIA phát triển thành 3 dạng khuẩn lạc. Các chủng vi khuẩn gram âm tạo thành 2 dạng khuẩn lạc gồm nhóm khuẩn lạc có màu trắng trong, nhỏ li ti sau 24 giờ ủ. Sau 48 giờ ủ khuẩn lạc tròn lồi, có rìa răng cưa, kích thước 0,5 - 2mm. Vi khuẩn bắt màu hồng, hình que ngắn, cho phản ứng Catalase dương tính và Oxidase âm tính. Điều đáng lưu ý là các chủng vi khuẩn này được thu từ cá rô đen thân có biểu hiện hoại tử ở cơ quan nội tạng. Nhóm khuẩn lạc thứ hai phát triển rất nhanh sau 18 - 24h, tạo thành các khuẩn lạc vàng, nhẵn, lồi, kích thước 1,5 - 2,5 mm. Khi tiến hành nhuộm gram vi khuẩn bắt màu hồng, gram âm, có dạng trực khuẩn ngắn, cho phản ứng Catalase và Oxidase
dương tính. Ngoài ra các vi khuẩn gram âm đều phát triển được trên môi trường MacConkey Agar nên kết quả đ ịnh danh sơ bộ đều thuộc họ vi khuẩn đường ruột.
Các vi khuẩn gram dương phát triển thành khuẩn lạc tròn, màu trắng sữa, bóng, lồi thấp, rìa đều, tâm đậm hơn rìa, kích thước 0,5 - 1,5 mm. Kết quả định danh sơ bộ cho thấy các vi khuẩn này thuộc giống Streptococcus với các đặc điểm gram dương, hình cầu dạng chuỗi, cho phản ứng Oxidase (-), Catalase (-).nên chúng tôi định danh bằng bộ test API 20Strep. 11 chủng vi khuẩn thuộc giống Streptococcus đã được định dang bằng kit API 20Strep. Kết quả cho thấy rằng các chủng vi khuẩn này là Streptococcus agalactiae.
Đối với các chủng vi khuẩn gram âm dựa vào kết quả định danh sơ bộ về các phản ứng Oxidase và Catalase, chúng tôi tiến hành cấy các chủng vi khuẩn này trên môi trường chọn lọc MacConkey Agar và nhận thấy chúng phát triển tốt trên môi trường này. Do đó chúng tôi sử dụng kit API 20E định danh cho nhóm vi khuẩn đường ruột.
12 chủng vi khuẩn gram âm phát triển thành khuẩn trắng nhỏ sau 48 giờ được thử các phản ứng sinh hóa bằng kit API 20E. Kết quả cho thấy rằng các chủng vi khuẩn này chính là Edwardsiella ictaluri. Tuy nhiên, có sự khác biệt so với các chủng E. ictaluri gây bệnh trên cá tra trong nghiên cứu của Từ Thanh Dung và cộng tác viên (2003). Cả 9 chủng vi khuẩn từ cá rô đồng được đều cho kết quả dương tính ở phản ứng MEL và ARA trong khi đó các chủng Edwardsiella ictaluri phân lập được từ cá tra lại âm tính ở các phản ứng này.
Trong số 40 chủng vi khuẩn tạo khuẩn lạc có màu vàng, nhẵn, lồi, phát triển nhanh sau 18- 24h, 8 chủng được định danh bằng kit API 20E. Kết quả cho thấy rằng các chủng vi khuẩn đều là Aeromonas hydrophila (Nguyễn Hữu Thịnh và ctv, 2011).
Bảng 5: Tỷ lệ cá rô phân lập được các loài vi khuẩn
Theo nghiên cứu của Phạm Thị Thùy Mỹ (2011) trên mẫu cá rô bệnh thu tại 6 ao ở Hậu Giang và 2 ao ở Cần Thơ, cá có dấu hiệu bỏ ăn, bơi dạng xoắn lờ đờ trên mặt nước, thân sậm màu hoặc đen. Quan sát não thận và tỳ tạng cá bằng phương pháp phết kính nhuộm Giemsa phát hiện nhiều cụm vi khuẩn hình cầu. Phân tích vi sinh ở cá rô bệnh đã thu được 8 chủng vi khuẩn trong đó có 5 chủng vi khuẩn Streptococcus agalactiae và 3 chủng Streptococcus iniae.
Còn theo nghiên cứu của Nguyễn Duy Khương (2011) kết quả phân lập 62 mẫu cá rô bệnh đen thân và 4 mẫu cá khỏe tại 9 ao nuôi ở Cần Thơ và Hậu Giang đã xác định được 2 loài vi khuẩn Streptococcus sp1 và Streptococcus sp2 với tần xuất xuất hiện tương ứng 44% và 56 %. Chủng Streptococcus sp1 phát triển tốt trên môi trường thạch máu, không có khả năng dung huyết, tồn tại ở 60 oC, 6,5 % NaCl và pH =9,6; chủng Streptococcus sp2 phát triển tốt trên cả hai môi trường TSA và thạch máu, có khả năng dung huyết, phát triển ở 6,5 % NaCl nhưng không tồn tại ở 60 oC và pH =9,6.
Kết quả kiểm tra độ nhạy của 2 chủng Streptococcus R17 và R47 với 9 loại kháng sinh đã cho kết quả kháng với gentemycin và streptomycin và nhạy với penicillin, ampicillin, enrofloxacin (đã cấm sử dụng), tertracycline, chloramfericol (đã cấm sử dụng) và rifampicin. Riêng trimethorime + sulfamethoxazol không hiệu lực trên chủng R17 nhưng lại nhạy với chủng R47.
Gây cảm nhiễm xác định LD50 tại thời điểm 168h trên chủng Streptococcus sp1 (R17) là 8,71x104 CFU/ml và Streptococcus sp2 (R47) là 7,8x104 CFU/ml.
Bảng 6: Kết quả độ nhạy kháng kháng sinh đồ trên chủng R17 và R47
5. Kết luận
Qua ba nghiên cứu của Nguyễn Duy Khương (2011), Phạm Thị Thùy Mỹ ( 2011), Nguyễn Hữu Thịnh và ctv (2011) bước đầu có thể xác định nguyên nhân gây bệnh đen thân trên cá rô là do ký sinh trùng Trypanosoma và hai loài vi khuẩn Streptococcus agalactiae, Streptococcus iniae. Từ kết quả của những nghiên cứu này có thể đưa ra quy trình phòng và trị bệnh đen thân cho các rô như sau:
Phòng bệnh:
- Chọn nguồn con giống tốt sạch bệnh.
- Duy trì chất lượng nước tốt (hút bùn đáy sau mỗi vụ nuôi; thay nước định kỳ; sử dụng các sản phẩm hấp thu khí độc như: than hoạt tính, Zeolite, Yucca; duy trì ổn định sự phát triển của tảo trong ao nuôi)
- Sát khuẩn nguồn sau nước định kỳ (7 ngày một lần) và sau khi cấp nước mới -> nhằm tiêu diệt vi khuẩn có hại trong ao nuôi..
- Định kỳ trộn thuốc sổ giun sán cho cá 1 tháng 1 lần (nên thay đổi gốc thuốc sổ)
- Bổ sung Vitamin tổng hợp, men tiêu hóa, giải độc gan, Beta-Glucan nhằm tăng sức đề kháng và khả năng hấp thu chất dinh dưỡng từ thức ăn.
- Định kì 7 ngày một lần lấy mẫu cá ngẫu nhiên đem kiểm tra dưới kính hiển vi (mang, nhớt, đường ruột) -> phát hiện sớm kí sinh trùng để có biện pháp phòng trị kịp thời.
Trị bệnh:
- Vớt hết cá cá chết và cá có dấu hiệu bệnh.
- Thay nước mới cho ao nuôi.
- Sát khuẩn nguồn nước (TCCA 90, Chlorine, BKC…)
- Dùng một trong các loại kháng sinh sau: Penicillin, Ampicillin, Tertracycline, Rifampicin, Doxycycline; liều lượng mỗi loại từ 50-70 mg/ kg cá liên tục 3-5 ngày; lưu ý giảm thức ăn xuống ½ so với lúc cá khỏe.
Tài liệu tham khảo
Nguyễn Hữu Thịnh, Bùi Thị Kim Cương, Đỗ Viết Phương, 2011. Một trường hợp nhiễm nặng Trypanosoma sp trên cá rô đồng (Anabas testudinus) nuôi thâm canh. Khoa Thủy Sản, Trường Đại học Nông Lâm TP. HCM
Nguyễn Duy Khương, 2011. Xác định tác nhân gây bệnh đen thân trên cá rô đồng (Anabas testudineus). Luận văn tốt nghiệp đại học. Đại học Cần Thơ.
Phạm Thị Thùy Mỹ, 2011. Xác định đặc điểm bệnh học do vi khuẩn trên cá rô đồng (Anabas testudineus) nuôi thương phẩm. Luận văn tốt nghiệp đại học. Đại học Cần Thơ








_1769399561.jpg)
_1769398435.jpg)
_1769233765.jpg)








_1769233765.jpg)
_1769233450.jpg)
_1769154645.jpg)

_1769142224.jpg)


