Tôm nhiễm virus đốm trắng (WSSV) thường chết trong vòng 07 ngày, với tỷ lệ xấp xỉ 100%. Các protein virus của WSSV (VP) 15, VP19, VP24, VP26 và VP28 đóng vai trò quan trọng trong quá trình lây nhiễm bệnh. Cho đến nay, không có phương pháp nào hiệu quả để điều trị hoặc ngăn ngừa WSSV có khả năng lây nhiễm cao, có thể là do tôm thiếu khả năng miễn dịch thích nghi. Tuy nhiên, việc phòng WSSV có thể thực hiện được thông qua việc hệ thống miễn dịch của tôm nhận biết các protein cấu trúc của nó, VP19 và VP28.
Ví dụ, phiên bản tái tổ hợp của VP28, một protein vỏ đóng vai trò chính trong việc lây nhiễm WSSV, được cho là có tác dụng bảo vệ chống lại WSSV. Do đó, vaccine WSSV, chẳng hạn như vaccine nano RNA và vaccine bất hoạt, đã được nghiên cứu trong nhiều năm. Tuy nhiên, xem xét quy mô của các trang trại nuôi tôm, việc tiêm cho từng cá thể tôm là không thể và do đó, vaccine dạng cho ăn được cung cấp với thức ăn là hướng đi khả thi hơn.
Chlorella hay còn gọi là tảo lục, là một loại vi tảo quang hợp có tốc độ tăng trưởng nhanh. Bởi vì các loài Chlorella rất dễ nuôi, chỉ cần cung cấp carbon và năng lượng nên chúng có thể mang lại hàm lượng protein cao trong hệ thống nuôi được kiểm soát hiệu quả. Tảo lục được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ chứng nhận “thường được công nhận là an toàn”, được sử dụng làm phụ gia thức ăn cho tôm thay thế cho bột cá.
 Tôm thẻ chân trắng. Ảnh: thuysanvietnam
Tôm thẻ chân trắng. Ảnh: thuysanvietnam
Ngoài ra, thành tế bào cứng của vi tảo có thể bao bọc các protein tái tổ hợp được biểu hiện và bảo vệ chúng khỏi các điều kiện khắc nghiệt của độ pH thấp và các enzyme tiêu hóa, từ đó tạo ra cả hệ thống miễn dịch toàn thân và niêm mạc. Do những ưu điểm này, vi tảo được đề xuất như một hệ thống phân phối khả thi cho vắc-xin chống lại S-glycoprotein SARS-CoV-2 hoặc dạng hòa tan của thụ thể ACE2 hòa tan làm mồi liên kết cho S-glycoprotein. Nghiên cứu mới đây của Đại học Quốc gia Pukyong (Hàn Quốc) đã phát triển vaccine WSSV đường uống sử dụng Chlorella tái tổ hợp biểu hiện VP28.
Chủng C. vulgaris PKVL7422 được sử dụng trong nghiên cứu này đã được phân lập trong phòng thí nghiệm và được gửi vào Bộ sưu tập các loại hình nuôi của Hàn Quốc (KCTC 13361BP). C. vulgaris PKVL7422 được nuôi trong môi trường BG11 biến tính (BG11 bổ sung glucose ở mức 0,5% w/v) dưới ánh sáng ở mật độ dòng photon là 50 μmol photon m−2 s−1 và nhiệt độ 20°C. Một gen VP28 (GenBank số AY422228.1) với sự tối ưu hóa codon cho C. vulgaris đã được Bioneer (Daejeon, Hàn Quốc) tổng hợp. Plasmid biểu hiện VP28, pCCWVP28, được tạo ra bằng cách sửa đổi vectơ biến đổi Chlorella đã phát triển trước đó, pCCVG (Hình 1a). Plasmid pCCVG và phần chèn (đoạn VP28) được tiêu hóa bằng cách sử dụng enzyme giới hạn BamHⅠ và XhoⅠ, sau đó được nối để tạo ra plasmid pCCWVP28. Plasmid pCCWVP28 có hai chuỗi sườn (dài 1000 bp) có nguồn gốc từ gen NR của C. Vulgaris PKVL7422, cho phép nó tích hợp thông qua tái tổ hợp tương đồng, bao gồm trình tự khởi đầu 35S của virus, gen VP28 và trình kết thúc phiên mã từ Rbcs2 gen của Chlamydomonas reinhardtii.
Kết quả chọn lựa Chlorella vulgaris biến đổi
Sau 2 tuần nuôi cấy, quan sát thấy các khuẩn lạc trên các đĩa chứa C. vulgaris biến nạp nhưng không quan sát thấy trên các đĩa chứa loại C. vulgaris tự nhiên, không biến nạp (Hình 2). Phân tích PCR trên các khuẩn lạc C. vulgaris biến nạp được chọn ngẫu nhiên cho thấy các sản phẩm có kích thước như mong đợi. Phân tích Western blot cho thấy sự biểu hiện của protein 28 kDa trong sáu mẫu Chlorella biến nạp được chọn ngẫu nhiên nhưng không biểu hiện ở loại C. vulgaris tự nhiên không biến nạp. Một chất biến đổi có tên TF1, biểu hiện mức protein VP28 tái tổ hợp cao nhất, đã được sử dụng trong các thí nghiệm tiếp theo.
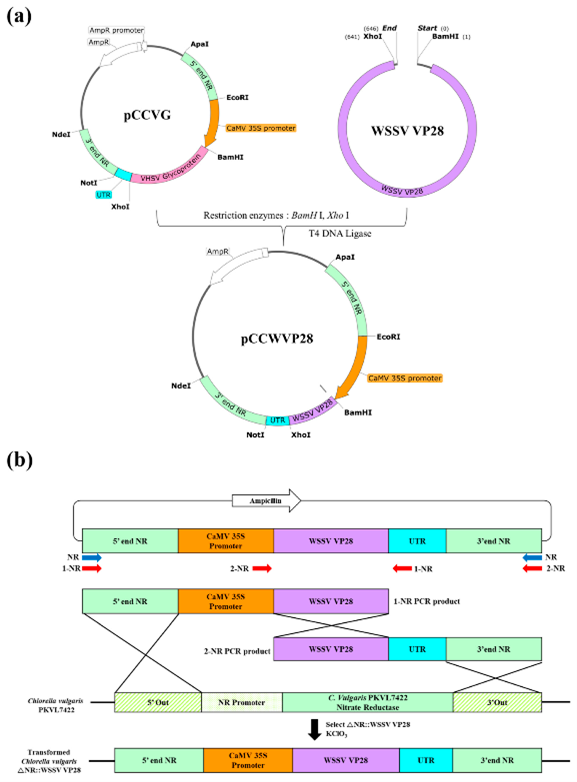
Hình 1. Cấu trúc và biểu diễn sơ đồ cấu trúc của plasmid pCCWVP28
Cấu trúc và biểu diễn sơ đồ cấu trúc của plasmid pCCWVP28 để biến đổi Chlorella vulgaris. (a) Gen glycoprotein VHSV trong plasmid pCCVG đã được thay thế bằng gen VP28 được tối ưu hóa bằng codon để tạo ra plasmid pCCWVP28. (b) Quá trình biến đổi được thực hiện bằng hệ thống biến đổi NR phân tách với hai đoạn DNA chèn. Ba sự kiện trao đổi chéo dẫn đến việc thay thế gen NR kiểu tự nhiên bằng đoạn DNA chèn vào, cho phép chọn lọc các chất biến đổi sử dụng KClO3.
Trước khi thử nghiệm điều trị cho tôm và thử nghiệm cảm nhiễm với WSSV, 10 trong số 250 con tôm được sử dụng trong nghiên cứu này đã được chọn ngẫu nhiên và sự hiện diện của WSSV được kiểm tra bằng phương pháp PCR tiêu chuẩn và PCR lồng ghép. Những phân tích này không tiết lộ các sản phẩm PCR có kích thước dải dự kiến (604 và 258 bp), được phát hiện trong đối chứng dương (Hình 3a, b). Ở tôm bị nhiễm WSSV được sử dụng làm vật liệu cấy dựa trên thức ăn, phân tích qPCR của các mô cơ và đường tiêu hóa cho thấy hiệu giá virus lần lượt là 5,02 × 105 và 6,08 × 105 bản sao/mg (Hình 3c).

Hình 2. Lựa chọn C. vulgaris biến nạp và xác nhận bằng phương pháp PCR và phân tích Western blot.
Lựa chọn C. vulgaris biến nạp và xác nhận bằng phương pháp PCR và phân tích Western blot. (a) Loại PKVL7422 tự nhiên trên tấm BGNK chứa 200 mM KClO3. (b) Các khuẩn lạc C. vulgaris PKVL7422 biến nạp trên đĩa BGNK chứa 200 mM KClO3. (c) Kết quả PCR của các tế bào biến đổi được chọn ngẫu nhiên. Ngõ DM: Điểm đánh dấu DNA DM3200 (SMOBIO); ngõ N: điều khiển âm; ngõ WT: loại tự nhiên C. Vulgaris; ngõ P: kiểm soát tích cực với pCCWVP28; làn đường TF1–10: biến đổi C. vulgaris. ( d ) Phân tích Western blot biểu hiện VP28 bằng các chất biến đổi được chọn. Ngõ M: Điểm đánh dấu protein PM2700 (SMOBIO); ngõ WT: loại tự nhiên C. vulgaris; làn WSSV: protein tổng số từ tôm nhiễm virus đốm trắng (WSSV); làn TF1, 2, 7, 8, 9 và 10: Nhận dạng PCR C. vulgaris biến nạp.
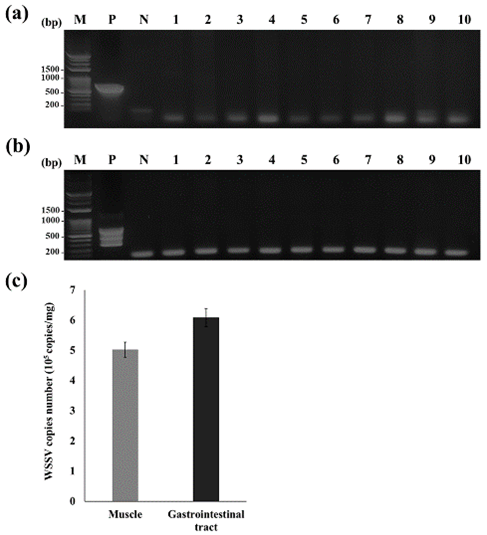
Hình 3. Sự hiện diện của nhiễm WSSV ở tôm thử nghiệm
Sự hiện diện của nhiễm WSSV ở tôm thử nghiệm. (a) Xác nhận nhiễm WSSV bằng PCR tiêu chuẩn. (b) Xác nhận nhiễm WSSV bằng phương pháp PCR lồng. Ngõ M: Dấu DNA DM3200 (SMOBIO); ngõ P: đối chứng dương tính (tổng số DNA từ tôm thẻ chân trắng bị nhiễm WSSV); ngõ N: điều khiển âm; làn 1–10: tổng số DNA từ tôm khỏe mạnh được sử dụng cho thử nghiệm cảm nhiễm. (c) Đo hiệu giá WSSV trong các mô tôm được chỉ định.
Kết quả về hiệu quả của vaccine uống
Phân tích tỷ lệ chết cho thấy rằng ở nhóm đối chứng dương nhận được thức ăn bình thường, tỷ lệ chết cộng dồn cuối cùng vào ngày 20 sau thử thách WSSV là 100%, trong khi không thấy tỷ lệ chết ở nhóm đối chứng âm (không có thử thách WSSV) (Hình 4). Khi so sánh với tôm được nuôi bằng loại C. vulgaris tự nhiên, có tỷ lệ chết cộng dồn cuối cùng là 77,8%, tôm được nuôi bằng C. vulgaris biểu hiện VP28 có tỷ lệ chết cộng dồn cuối cùng là 20% và tỷ lệ sống tương đối (RPS) là 80 % (p < 0,001, Hình 4a). Tất cả tôm chết đều có đốm trắng trên bề mặt bên trong mai, đây là dấu hiệu điển hình của bệnh WSD (Hình 4b). Hơn nữa, nhiễm WSSV đã được xác nhận bằng phương pháp PCR, cho thấy có 258 bp sản phẩm dự kiến trong các mẫu DNA từ tất cả tôm chết nhưng không có trong DNA từ đối chứng âm (Hình 4c).
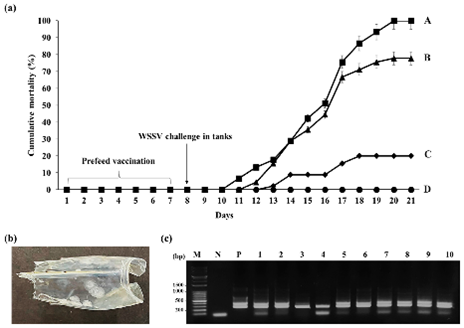
Hình 4. Tỷ lệ chết cộng dồn của tôm thẻ sau khi sử dụng vaccine và sau khi cảm nhiễm với WSSV.
(a) Lịch sử dụng vaccine và cảm nhiêm cũng như tỷ lệ chết cộng dồn sau cảm nhiễm. (●) Đối chứng âm không được sử dụng vaccine. (■) Không sử dụng vaccine, kiểm soát dương tính. (▲) Nhóm được cho ăn loại tự nhiên C. vulgaris. (◆) Nhóm được nuôi bằng C. vulgaris đã biến đổi. Dữ liệu là giá trị trung bình ± độ lệch chuẩn của ba lần lặp. Các chữ cái cho thấy sự khác biệt đáng kể (p < 0,001). (b) Vỏ đầu của tôm thẻ chết sau cảm nhiễm. (c) Nhiễm WSSV được xác nhận bằng phân tích PCR lồng. Ngõ M: Dấu DNA DM3200 (SMOBIO); ngõ N: điều khiển âm; ngõ P: DNA tổng số từ tôm được sử dụng làm vật liệu cấy đối chứng dương tính; làn 1–10: tổng số DNA từ tôm đã chết sau cảm nhiễm. Dải trên và dải dưới trong đối chứng dương lần lượt là các sản phẩm PCR sơ cấp và lồng. Dải trong làn điều khiển âm là DNA mồi.
Kết quả phân tích RT-qPCR của các gen phản ứng miễn dịch
Phân tích RT-qPCR về mức độ biểu hiện của proPO, ALF và CTL bằng cách sử dụng RNA tổng số được chiết xuất từ mô gan tụy của tôm đã được sử dụng vaccine cho thấy rằng khi so sánh với các mẫu thu được từ nhóm đối chứng dương ngay sau khi được cho ăn thức ăn bình thường, proPO, ALF và CTL được điều chỉnh tăng đáng kể vào ngày thứ 7 và 14 sau khi cho tôm ăn với C. vulgaris biểu hiện VP28 (Hình 5). Gen proPO được biểu hiện cao nhất và cao hơn lần lượt là 29,6 lần và 28,2 lần vào ngày thứ 7 và 14 sau khi chủng ngừa. Vào ngày thứ 7 sau khi chủng ngừa, nồng độ ALF và CTL tăng lần lượt 12,1 lần và 10,1 lần, trong khi vào ngày 14, mức độ của chúng tăng lần lượt 15 lần và 11,5 lần khi so sánh với nhóm đối chứng. Ở tôm được nuôi bằng loại C. vulgaris tự niên, mức độ phiên mã của proPO, ALF và CTL lần lượt cao hơn 1,2 lần, 3,2 lần và 1,1 lần vào ngày thứ 7 và 1,0 lần, 2,9 lần và 1,0 lần vào ngày 14, tương ứng khi so sánh với tôm được cho ăn thức ăn thông thường (p < 0,001, Hình 5).
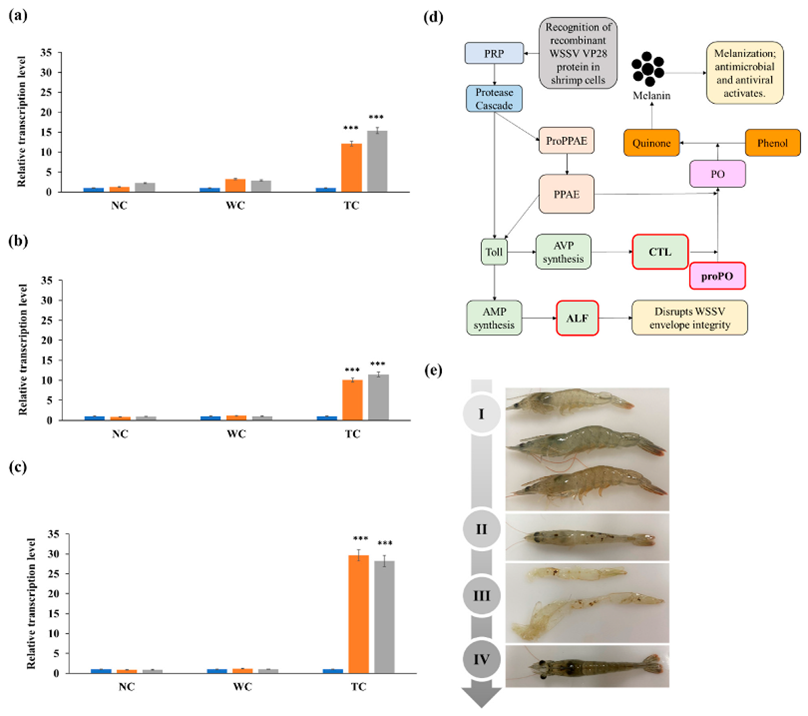
Hình 5. Mức độ phiên mã của các gen liên quan đến miễn dịch sau khi sử dụng thức ăn.
(a–c) Phân tích RT-qPCR về mức độ mRNA của yếu tố kháng lipopolysaccharide (ALF), lectin loại C (CTL) và gen prophenoloxidase (proPO) ở tôm thẻ chân trắng vào ngày 0 (thanh màu xanh), 7 ( thanh màu cam) và 14 (thanh màu xám), sau khi chủng ngừa bằng Chlorella Vulgaris biểu hiện VP28. Dữ liệu là giá trị trung bình ± độ lệch chuẩn của ba lần lặp. *** biểu thị sự khác biệt đáng kể ở p < 0,001. (d) Con đường miễn dịch của tôm. (e) Những thay đổi ở tôm sau khi sử dụng vaccine kháng WSSV qua đường uống. I: tôm khỏe mạnh; II: hắc tố hóa; III: bài tiết qua lớp biểu bì; IV: tôm đã hồi phục sức khỏe.
Khi được sử dụng dưới dạng vaccine bổ sung thức ăn bằng C. Vulgaris PKVL7422 biểu hiện VP28 cho thấy tác dụng bảo vệ chống lại nhiễm WSSV. Hơn nữa, tôm được tiêm phòng biểu hiện mức độ cao của các gen proPO, ALF và CTL, có liên quan đến việc bảo vệ tôm chống lại nhiễm WSSV. Do tạo ra lượng protein vaccine VP28 cao và có chi phí sản xuất thấp, dễ áp dụng và hiệu quả bảo vệ cao nên nó có tiềm năng lớn để sử dụng trong sản xuất vaccine công nghiệp cho tôm, có thể là một công cụ có giá trị để phòng bệnh trong ngành nuôi tôm.



_1772124797.png)





_1769663223.jpg)

_1769399561.jpg)
_1762138517.jpg)

_1771908780.jpg)
_1771901893.png)




