1. Thuốc là gì?
Luật liên bang (Đạo luật Liên bang về Thực phẩm, Dược phẩm và Mỹ phẩm) định nghĩa thuật ngữ "thuốc" bao gồm "các sản phẩm dành cho sử dụng trong chẩn đoán, chữa, giảm thiểu, điều trị, hoặc phòng ngừa bệnh ở người và các loài động vật khác" và "các sản phẩm (không bao gồm thực phẩm) được dùng với mục đích tác động lên cấu trúc hoặc bất kỳ chức năng nào của cơ thể con người hoặc của các loài động vật khác."
Xem xét thực tế hơn về định nghĩa này trên phương diện nuôi trồng thủy sản, một loại thuốc (“sản phẩm") có thể được ví dụ như một thứ dùng để điều trị một căn bệnh trên thủy sản hoặc nhằm tác động đến cấu trúc hay chức năng trên cơ thể của loài thủy sản đó. Việc sử dụng có mục đích của một sản phẩm là xác định xem liệu sản phẩm đó có phải là thuốc hay không.
Khi sử dụng có mục đích chất formalin - một dạng hòa tan của hợp chất hữu cơ formaldehyde – để xác định một mẫu sinh thiết từ cá, thi đây không phải là thuốc do dùng với mục đích để bảo quản mẫu thịt cá phục vụ nghiên cứu trong tương lai. Tuy nhiên, trong trường hợp sử dụng formalin để tiêu diệt các loài vi khuẩn kí sinh trên loài cá, thì đây được coi là thuốc do được dùng cho điều trị kí sinh trùng. Do đó, với trường hợp việc sử dụng có mục đích formalin để điều trị bệnh thì chất này sẽ được coi là thuốc theo luật liêng bang.
Xem xét một phần khác trong định nghĩa – phần về loại thuốc gây ảnh hưởng đến cấu trúc hoặc chức năng của cơ thể cá. Khi sử dụng có mục đích chất tricaine methanesulfonate, hoặc MS-222, để cố định con cá, đây được coi là một loại thuốc do sử dụng với mục đích thay đổi chức năng cơ thể cá như thế nào đó. Khi sử dụng có mục đích chất oxytetracycline hydrochloride để đánh dấu sỏi tai của cá bột và cá giống nhằm nhận dạng trong tương lai, đây được coi là một loại thuốc vì được sử dụng với mục đích tác động đến cấu trúc của các cơ quan của cá (trong trường hợp này là sỏi tai của cá).
2. Thuốc thú y mới được phê duyệt là gì?
Một số loại thuốc được FDA phê duyệt để sử dụng cho thủy sản, điều đó có nghĩa là gì?
Thuốc mới được phê duyệt phải trải qua các quy trình Đơn xin chứng nhận Thuốc thú y mới (NADA), hoặc Đơn xin chứng nhận Thuốc thú y mới dạng viết tắt (ANADA) dành cho các loại thuốc thú y nói chung. Tóm lại, quy trình này bao gồm việc đơn vị hỗ trợ cho một loại thuốc – thường là một công ty dược – thu thập các thông tin về độ an toàn, hiệu quả và các thông tin khác đối với việc sử dụng có mục đích một loại thuốc thú y. Sau đó, đơn vị hỗ trợ phải gửi những thông tin này đến Cục Quản lý Thực phẩm và Dược phẩm (FDA) dưới dạng đơn xin chứng nhận NADA hoặc ANADA. Nếu đơn đáp ứng các yêu cầu phê duyệt, FDA sẽ phê duyệt loại thuốc mới này. FDA chỉ phê duyệt loại thuốc dành cho các mục đích sử dụng cụ thể được nêu trên nhãn sản phẩm thuốc.
Ngành công nghiệp nuôi trồng thủy sản, các công ty dược và các cơ quan chính phủ cùng hợp tác trong lĩnh vực công để hỗ trợ cho nghiên cứu về thuốc thú y với hy vọng nghiên cứu đó sẽ dẫn tới việc có mặt các loại thuốc thú y thủy sản được kinh doanh hợp pháp hơn trên thị trường. Các đối tác công tiến hành những nghiên cứu về sự an toàn và hiệu quả của một một loại thuốc thú y thủy sản. Thông tin trên sẽ được chuyển thành Hồ sơ Thông tin tổng hợp (PMF) và được công bố ra công chúng. Thay vì phải tiến hành các nghiên cứu riêng, công ty dược có thể sử dụng thông tin trong PMF để đáp ứng các yêu cầu phê duyệt của FDA, từ đó giảm bớt thời gian và chi phí hoàn tất quy trình NADA. Điều này cũng khiến các công ty được khuyến khích hơn trong việc theo đuổi việc phê duyệt một loại thuốc thú y thủy sản, đặc biệt khi thuốc này chỉ có thị trường tiêu thụ nhỏ.
FDA duy trì một cơ sở dữ liệu tìm kiếm trực tuyến, có tên "Thuốc thú y @ FDA," cung cấp danh sách các loại thuốc thú y mới được phê duyệt, bao gồm cả thuốc thú y thủy sản.
3. Sự phê duyệt của FDA nói lên điều gì?
Sự phê duyệt của FDA đối với một loại thuốc thú y đảm bảo rằng:
• Loại thuốc này an toàn và hiệu quả khi được sử dụng theo hướng dẫn trên nhãn sản phẩm;
• Tác dụng, chất lượng và độ nguyên chất của thuốc đồng nhất giữa các lô hàng;
• Việc dán nhãn thuốc là đáng tin cậy và đầy đủ.
Nếu thuốc được dùng làm cho thức ăn cho gia súc nuôi làm thực phẩm, ví dụ như cá dành cho con người tiêu thụ, sự phê duyệt của FDA cũng đảm bảo rằng thực phẩm chế biến từ động vật đã qua điều trị thuốc an toàn cho người tiêu dùng.
FDA tiếp tục giám sát một loại thuốc thú y đã được phê duyệt kể cả sau khi được lưu hành trên thị trường để đảm bảo rằng:
• Thuốc vẫn an toàn và hiệu quả. Công tác giám sát sau phê duyệt của FDA đôi khi giúp phát hiện những vấn đề về an toàn và hiệu quả của thuốc chưa được biết đến vào thời điểm phê duyệt;
• Chất lượng và sự đồng nhất trong quá trình sản xuất được duy trì, và
• Việc ghi nhãn vẫn trung thực và đầy đủ.
4. Thế nào là một loại thuốc thú y được phê duyệt có điều kiện?
Bạn đã sử dụng AQUAFLOR-CA1 khi thuốc được phê duyệt có điều kiện”? Bạn không chắc chắn hiểu đúng ý nghĩa của thuật ngữ này? Điều đó có nghĩa là AQUAFLOR-CA1 đã đi qua quy trình Đơn xin chứng nhận Thuốc thú y mới có điều kiện (CNADA). Quy trình này có các yêu cầu phê duyệt giống với NADA, ngoại trừ việc FDA phê duyệt thuốc có điều kiện trước khi yêu cầu về xác minh tính hiệu quả được hoàn tất. Việc phê duyệt mang tính điều kiện của FDA đảm bảo thuốc này là an toàn và có cơ sở tin tưởng vào tính hiệu quả khi sử dụng theo hướng dẫn của nhãn sản phẩm.
Sự phê duyệt mang tính điều kiện mà công ty dược nhận được có hiệu lực trong một năm, và có thể được gia hạn hàng năm trong vòng 4 năm tiếp theo. Trong thời gian này, công ty có thể kinh doanh thuốc hợp pháp trong khi vẫn duy trì thu thập dữ liệu về tính hiệu quả. Khi công ty dược hoàn thành yêu cầu về tính hiệu quả, FDA có thể chấm dứt xem xét và, nếu thích hợp, sẽ phê duyệt toàn diện đơn xin chứng nhận. Phê duyệt mang tính điều kiện chỉ được áp dụng với thuốc dành cho các loài động vật nhỏ hoặc được sử dụng hạn chế cho các loài động vật nuôi chính.
AQUAFLOR-CA1 có nghĩa là sự phê duyệt có điều kiện lần thứ nhất của sản phẩm thuốc thú y này. FDA duyệt duyệt có điều kiện sản phẩm AQUAFLOR-CA1 sử dụng cho việc kiểm soát tỷ lệ chết đối với cá da trơn do bệnh nhiễm khuẩn Flavobacterium columnare gây ra. [Chữ “CA1” sau tên thuốc chỉ ra rằng thuốc này được phê duyệt có điều kiện (CA) và rằng đơn xin chứng nhận của thuốc đã được phê duyệt có điều kiện lần thứ nhất.] Tháng 4/2012, FDA đã hoàn toàn phê duyệt AQUAFLOR để kiểm soát tỷ lệ chết do bệnh nhiễm khuẩn Flavobacterium columnare gây ra trên tất cả các loài cá vây, bao gồm cả cá da trơn. Chữ CA1 sau tên thuốc được bỏ đi ngay sau khi thuốc hoàn toàn được phê duyệt cho mục đích sử dụng này.
Hiện không có loại thuốc thú y được phê duyệt có điều kiện nào đang lưu hành.
5. Phê chuẩn có điều kiện có phải là cách hợp pháp duy nhất để đưa một loại thuốc thú y mới ra thị trường?
Không phải như vậy.
Một số loại thuốc thú y có thể theo một cách khác như: ghi vào danh mục tra cứu. Các loại thuốc thú y được cho vào danh mục tra cứu là loại thuốc không được thông qua về mặt kỹ thuật nhưng vẫn được bán một cách hợp pháp trên thị trường cho một số loài thứ yếu.
Bạn có thể tìm hiểu, hay thậm chí sử dụng 2 loài thuốc thú y được cho vào danh mục tra cứu dành cho cá cảnh như: OVAPRIM (salmon gonadotropin releasing hormone analog + domperidone) and AQUACALM (metomidate hydrochloride). Cả hai loại thuốc này hiện đang có trong Danh sách tra cứu các loại thuốc thú y mới cho một số loài không quan trọng không được cho phép lưu hành hợp pháp trên thị trường của FDA, được gọi đơn giản là danh mục tra cứu. Thuốc đã liệt kê trong danh mục này có thể được được bán trên thị trường một cách hợp pháp để sử dụng cho một loài nhỏ nhất định.
Danh mục thuốc cho phép sử dụng đối với:
· Các loài nhỏ thứ yếu được sử dụng để sản xuất thực phẩm, như cá cảnh. Các loài động vật không được dùng để làm nguyên liệu sản xuất thức ăn cho con người;
· Giai đoạn đầu đời của các loài thứ yếu được sử dụng để sản xuất thực phẩm, như hàu trứng (hàu chưa trưởng thành). Bởi vì con người thường không ăn hàu trứng, thuốc dùng để điều trị bệnh trong hàu trứng có thể bị liệt kê, nhưng thuốc dùng điều trị bệnh cho hàu lớn, loài mà mọi người thường ăn, có thể không bị liệt kê trong danh mục.
Liệt kê các loại thuốc là một quá trình có 3 bước bao gồm việc xem xét độ an toàn và hiệu quả của thuốc được thực hiện bởi một nhóm các chuyên gia chất lượng bên ngoài không thuộc FDA. Tất cả các thành viên trong nhóm chuyên gia này phải đồng ý rằng việc sử dụng thuốc theo hướng dẫn trên nhãn, lợi ích của thuốc có nhiều tác dụng hơn những rủi ro đe dọa tới loài đang được điều trị. Nếu FDA đồng ý với nhóm chuyên gia, thuốc sẽ được cho vào danh mục này.
Văn phòng phát triển việc sử dụng thuốc thú y với lượng nhỏ hay với loài nhỏ của CVM truy trì danh mục này.
6. Làm thế nào tôi có thể tìm ra loại thuốc thú y được lưu hành trên thị trường một cách hợp pháp?
Để tìm hiểu xem một loại thuốc thú ý được bán một cách hợp pháp, nhìn vào nhãn thuốc để biết con số và thông báo cụ thể. FDA thường ấn định 6 số duy nhất cho tất cả các loại thuốc thú ý đã được cho phép, được cho phép có điều kiện và được cho vào danh mục. Ví dụ như:
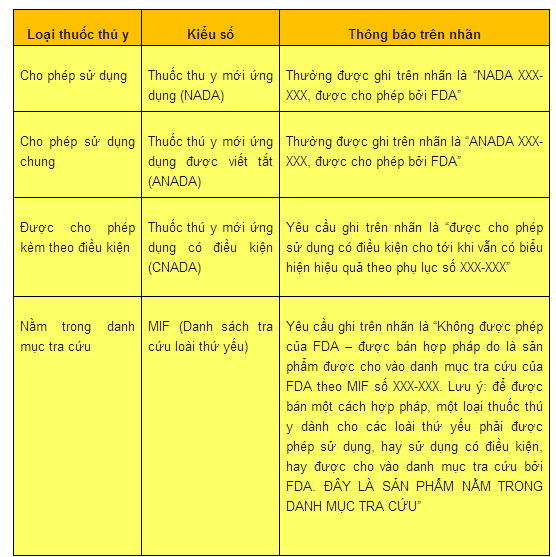
Bạn không nên nhầm lẫn những con số này với số mã thuốc quốc gia (NDC), những số mà đôi khi cũng được ghi trên nhãn thuốc. FDA thường ấn định 10 chữ số NDC nhất định cho loại thuốc dùng để nhận diện các loài thuốc này. Việc ghi số NDC trên nhãn thuốc không có nghĩa là thuộc này được FDA cho phép hay được bán hợp pháp.
7. Sự khác biệt giữa một thuốc thành phẩm và một hoạt chất là gì?
Bạn có thể tự hỏi tại sao 35% PEROX-AID, một loại thuốc được cho phép sử dụng cho cá với hydrogen peroxide như một hoạt chất, khác với các thuốc có nguồn gốc hydrogen peroxide.
Trong bối cảnh thuật ngữ thuốc được cho phép, hay cho phép có điều kiện, hay nằm trong danh mục tra cứu được dùng để chỉ sản phẩm thuốc thành phẩm. Sản phẩm thuốc thành phẩm bao gồm cả các thành phần hoạt tính và thành phần không hoạt tính.
Thành phần hoạt tính là thành phần biệt dược được dùng để điều trị như điều trị bệnh hay để thay đổi cấu trúc hay chức năng của cơ thể. Một loại thuốc có thể có một hoặc nhiều thành phần hoạt tính. Các thành phần không hoạt tính là tất cả các thành phần khác của sản phẩm thuốc thành phẩm như các chất tạo màu và tạo mùi, chất bảo quẩn, và các chất kết dính.
Khi FDA thông qua một loại thuốc, tổ chức này đã thông qua sản phẩm thuốc thành phẩm chứ không chỉ thành phần hoạt tính.
Giờ ta đã có cái nhìn khác đối với 35% PEROX-AID. Sản phẩm thuốc thành phẩm được thông qua là loại có chứa một hàm lượng hydrogen peroxide cụ thể, đã cho thấy việc sản xuất một cách nhất quán nhằm đảm bảo nồng độ, chất lượng và độ tinh khiết của thuốc. Sản phẩm thuốc thành phẩm cũng đã chứng minh là an toàn và có hiệu quả trong việc kiểm soát tỷ lệ cá bị chết do nấm và vi khuẩn. Sản phẩm hydrogen peroxide khác, ngay cả ở cùng một nồng độ, cũng không giống như 35% PEROX-AID. Các sản phẩm hydrogen peroxide không được thông qua có thể không an toàn hay không có hiệu quả đối với việc điều trị bệnh của cá, hay chất lượng và quá trình sản xuất không đảm bảo được sự nhất quán.
8. Sự khác biệt giữa thuốc thú y mới đã được phê chuẩn và thuốc có chứng nhận INAD?
Bạn có thể đã được nghe rằng “Chương trình hợp tác phê chuẩn thuốc thú y thủy sản của Hội động vật hoang dã và thủy sản của Mỹ (AADAP) là cơ quan chịu trách nhiệm cho một INAD đối với thuốc giảm đau thủy sản AQUI-S® 20E (eugenol) và một số loại thuốc khác tuy nhiên bạn có thể chưa biết nó có nghĩa là gì.
Đầu tiên, hãy định nghĩa “INAD”. Từ viết tắt này có nghĩa là thuốc thú y mới đã được điều tra, nghiên cứu. “Một chứng nhận INAD” cho phép nhà kinh doanh thuốc này có thể vận chuyển thuốc để phục vụ cho các mục đích nghiên cứu.
Với các mục đích quản lý, Trung Tâm Quản lý Thuốc Thú y của FDA (CVM) gắn số hồ sơ INAD trong bước đầu của quy trình phê chuẩn. Nhà kinh doanh thuốc có thể dùng hồ sơ INAD như một công cụ để trao đổi với CVM. Ví dụ, nhà kinh doanh sử dụng hồ sơ này để trao đổi với CVM trước khi điều trị thủy sản. Trước khi thủy sản đã được điều trị đi vào nguồn cung thực phẩm, nhà kinh doanh phải xin cấp phép từ CVM và phải được trung tâm này cấp giấy phép sử dụng thực phẩm. Trước khi cấp chứng nhận này, CVM phải xác nhận rằng thủy sản đã qua điều trị phải là thực phẩm an toàn cho con người.
Khi thực hiện các nghiên cứu theo chứng nhận INAD, các nhà nghiên cứu tuân theo 1 quy trình nghiên cứu cụ thể cũng như các quy trình nhất định về thông báo kết quả, những khó khăn và các thông tin khác tới nhà kinh doanh. Tất cả thông tin trình lên CVM là những nội dung trong hồ sơ INAD. Với bất kỳ nghiên cứu nào được thực hiện theo chứng nhận INAD, thuốc chỉ được sử dụng cho mục đích nghiên cứu, hoặc nếu thuốc được phê chuẩn cho các mục đích sử dụng khác, có nghĩa là thuốc chưa được phê chuẩn cho mục đích điều tra nghiên cứu.
Trong trường hợp của AQUI-S® 20E, các bên liên quan trong lĩnh vực thủy sản có thể nhận được thuốc một cách hợp pháp bằng cách làm việc với AADAP theo chứng nhận INAD của chương trình.
Các bên này nếu hợp tác với AADAP và tuân theo các quy trình điều tra, các điều kiện cấp phép sử dụng thực phẩm và thông báo các yêu cầu có thể sử dụng hợp pháp thuốc giảm đau thủy sản cho các mục đích nghiên cứu.
Quay trở lại câu hỏi về sự khác biệt giữa một loại thuốc và một thành phần hoạt chất. Thành phần hoạt chất trong AQUI-S® 20E là eugenol, nhưng giấy phép sử dụng thực phẩm được cấp theo chứng nhận INAD của AADAP có phạm vi rất hẹp và cụ thể và không bao gồm tất cả các sản phẩm có chứa eugenol. Mặc dù dầu đinh hương có chứa eugenol, dầu đinh hương không giống như AQUI-S® 20E. Dầu đinh hương không được bao hàm trong chứng nhận sử dụng thực phẩm cũng như chưa được phê chuẩn. CVM lo ngại về khả năng một số thành phần của dầu đinh hương có thể gây ung thư (xem Guidance for Industry 150 để biết thêm chi tiết).
9. Tôi phải làm gì nếu tôi phát hiện những sai lỗi ở thuốc thủy sản?
Các vấn đề của bất kỳ loại thuốc nào, đã được phê duyệt hay chưa, bao gồm những tác dụng phụ và những sai lỗi trên sản phẩm. Tác dụng phụ của thuốc là những tác dụng không mong muốn liên quan đến 1 loại thuốc hoặc thiếu tác dụng (thuốc không phát huy được hết tác dụng của nó). Tác dụng phụ cũng bao gồm các phản ứng khó chịu đối với người tiếp xúc với thuốc đó. Sai lỗi trên sản phẩm là những vấn đề như bao bì lỗi hoặc mẫu mã khác thường của loại thuốc đó.
CVM khuyến khích các bác sĩ thú y, các chuyên gia y tế thủy sản, các nhà sinh học thủy sản, các nhà quản lý trại nuôi, các nhà nghiên cứu và những người nuôi động vật nên thông báo những tác dụng phụ hoặc những sai lỗi đối với các loại thuốc thú y đã được phê chuẩn tới các công ty dược phẩm. Luật Mỹ phẩm, Dược phẩm và Thực phẩm Liên bang yêu cầu các công ty dược phẩm trình tất cả các thông báo về các vấn đề mà họ nhận được lên FDA. Các thông báo về các vấn đề đối với thuốc thú y này sẽ giúp Văn phòng Giám sát của CVM xác định và điều chỉnh các vấn đề đối với thuốc thú y đã được phê chuẩn một cách dễ dàng hơn.
Đối với các thuốc thú ý chưa được phê chuẩn, bạn có thể tự mình thông báo tác dụng phụ và sai lỗi của sản phẩm tới FDA. Các thông tin thủy sản về cách thức thông báo tác dụng phụ của thuốc được đăng tải trên trang web của CVM.
10. Những lo ngại của FDA về thuốc thú y chưa được phê chuẩn là gì? Tại sao tôi phải quan tâm đến vấn đề này?
Thuật ngữ “Thuốc thú y chưa được phê chuẩn” có nghĩa là thuốc thú y được lưu hành bất hợp pháp ở Mỹ trong khi chưa được công nhận một cách có điều kiện hoặc chưa được FDA đưa vào danh sách các sản phẩm an toàn. FDA rất lo ngại về các loại thuốc này vì chúng có khả năng gây nguy hiểm cho sức khỏe của người và động vật. Những loại thuốc này chưa được FDA rà soát và có thể không đáp ứng các tiêu chuẩn khắt khe của cơ quan này về sự an toàn, hiệu quả và chất lượng. Thuốc thú y chưa được công nhận có thể không được dán nhãn hoặc được quảng cáo công khai.
Nếu 1 loại thuốc thú y chưa được FDA rà soát, các bác sĩ thú y, các nhà sinh học thủy sản, người nuôi động vật và những người khác không thể biết được sản phẩm đó có an toàn và hiệu quả hay không, quy trình sản xuất có phù hợp để đảm bảo chất lượng thuốc và sự thống nhất trong từng lô hàng được sản xuất. Do không có yêu cầu về việc thông báo sai lỗi và tác dụng phụ của các loại thuốc thú y chưa được phê chuẩn, Văn phòng Giám sát và Tuân thủ của CVM sẽ không thể dễ dàng xác định và điều chỉnh những bất cập của các loại thuốc này.
11. Các sản phẩm “được phép buông lỏng quản lý” là gì?
CVM đã xác định một số sản phẩm chưa được phê chuẩn vẫn được sử dụng trong nuôi thủy sản làm thực phẩm được gọi là sản phẩm “được phép buông lỏng quản lý”. Các sản phẩm này còn được coi là các sản phẩm có mức độ nguy hiểm thấp. Các sản phẩm này chưa được phê chuẩn. Tuy nhiên, theo Hướng dẫn về kiểm soát mối nguy đối với các sản phẩm thủy sản và cá của FDA, CVM xác định rằng tác động của các sản phẩm này đối với thủy sản không có khả năng gây nguy hiểm cho sức khỏe của người.
Lưu ý rằng việc CVM quyết định đó là những sản phẩm có mức độ nguy hiểm thấp không có nghĩa là chúng đã được FDA công nhận hoặc CVM đã công nhận đó là những sản phẩm an toàn và có hiệu quả với thủy sản. Cũng nên nhớ rằng, trong tương lai, CVM có thể sẽ có quan điểm khác về việc sử dụng bất kỳ sản phẩm có nguy cơ thấp nào. Mục tiêu hàng đầu của CVM là bảo vệ sức khỏe cộng đồng và khuyến khích các nhà kinh doanh thuốc thú y phải kinh doanh sản phẩm đã được chứng nhận. Điều này sẽ giúp các sản phẩm thuốc đáp ứng được những yêu cầu sản xuất và chữa bệnh trong ngành nuôi trồng thủy sản.
Hy vọng, bài báo đã giải đáp được nhiều thắc mắc của bạn về nuôi trồng thủy sản và FDA. Nếu bạn có thêm câu hỏi hoặc muốn biết thêm thông tin, hãy liên lạc với ban truyền thông của CVM theo số 240-276-9300 hoặc email [email protected].





_1770909192.png)




_1769233765.jpg)

_1764484326.jpg)
_1764238067.jpg)







